Nuove pubblicazioni
Gli scienziati hanno creato un composto "camaleontico" per trattare i tumori cerebrali resistenti ai farmaci
Ultima recensione: 02.07.2025

Tutti i contenuti di iLive sono revisionati o verificati da un punto di vista medico per garantire la massima precisione possibile.
Abbiamo linee guida rigorose in materia di sourcing e colleghiamo solo a siti di media affidabili, istituti di ricerca accademici e, ove possibile, studi rivisti dal punto di vista medico. Nota che i numeri tra parentesi ([1], [2], ecc.) Sono link cliccabili per questi studi.
Se ritieni che uno qualsiasi dei nostri contenuti sia impreciso, scaduto o comunque discutibile, selezionalo e premi Ctrl + Invio.
Un nuovo studio condotto dagli scienziati della Yale University descrive come un nuovo composto chimico attacca i tumori cerebrali resistenti ai farmaci senza danneggiare i tessuti sani circostanti.
Lo studio, pubblicato sul Journal of the American Chemical Society, rappresenta un passo importante nello sviluppo dei cosiddetti "composti camaleonti" che potrebbero essere utilizzati per combattere una serie di tumori pericolosi.
I gliomi si sviluppano in circa 6,6 casi ogni 100.000 persone ogni anno e in 2,94 casi ogni 100.000 persone entro i 14 anni. Escludendo le metastasi di altri tumori che raggiungono il sistema nervoso centrale, i gliomi rappresentano il 26% di tutti i tumori cerebrali (tumori cerebrali primari) e l'81% di tutti i tumori cerebrali maligni.
Per decenni, i pazienti con glioblastoma sono stati trattati con un farmaco chiamato temozolomide. Tuttavia, la maggior parte dei pazienti sviluppa resistenza al farmaco entro un anno. Il tasso di sopravvivenza a cinque anni per i pazienti con glioblastoma è inferiore al 5%.
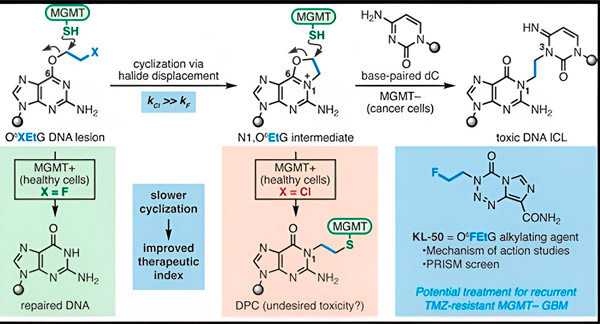
Nel 2022, il chimico di Yale Seth Herzon e il radioterapista Dr. Ranjit Bindra hanno sviluppato una nuova strategia per trattare i glioblastomi in modo più efficace. Hanno creato una classe di molecole antitumorali chiamate composti camaleonti, che sfruttano un difetto in una proteina di riparazione del DNA nota come O6-metilguanina DNA metiltransferasi (MGMT).
Molte cellule tumorali, compresi i glioblastomi, sono prive della proteina MGMT. Nuovi composti camaleontici sono progettati per danneggiare il DNA nelle cellule tumorali prive di MGMT.
I composti camaleontici innescano il danno al DNA depositando lesioni primarie sul DNA che, nel tempo, evolvono in lesioni secondarie altamente tossiche, note come legami crociati interfilamentari. MGMT protegge il DNA dei tessuti sani riparando le lesioni primarie prima che possano evolversi in legami crociati interfilamentari letali.
Per il loro nuovo studio, i coautori Herzon e Bindra si sono concentrati sul loro camaleonte principale, KL-50.
"Abbiamo utilizzato una combinazione di studi di chimica sintetica e biologia molecolare per chiarire le basi molecolari delle nostre osservazioni precedenti, nonché la cinetica chimica che fornisce la selettività unica di questi composti", ha affermato Herzon, Professore di Chimica Milton Harris a Yale. "Abbiamo dimostrato che il KL-50 è unico in quanto forma legami crociati del DNA solo nei tumori con difetti nella riparazione del DNA. Risparmia i tessuti sani."
Fonte: Journal of the American Chemical Society (2024). DOI: 10.1021/jacs.3c06483
Si tratta di una differenza significativa, sottolineano i ricercatori. Diversi altri composti antitumorali sono stati progettati per innescare legami crociati inter-catena, ma non sono selettivi per le cellule tumorali, il che ne limita l'utilità.
Il segreto del successo di KL-50 sta nella sua tempistica, hanno osservato i ricercatori. KL-50 forma legami crociati interfilamento più lentamente rispetto ad altri agenti crocianti. Questo ritardo dà alle cellule sane il tempo sufficiente per utilizzare MGMT per impedire la formazione di legami crociati.
"Questo profilo unico suggerisce il suo potenziale per il trattamento del glioblastoma farmaco-resistente, un'area con un'ampia esigenza clinica insoddisfatta", ha affermato Bindra, Professore di Radiologia Terapeutica "Harvey and Kate Cushing" presso la Yale School of Medicine. Bindra è anche direttore scientifico del Chenevert Family Brain Tumor Center presso lo Smilo Hospital.
Herzon e Bindra hanno affermato che il loro studio evidenzia l'importanza di considerare i tassi di modificazione chimica e di riparazione biochimica del DNA. Ritengono di poter utilizzare questa strategia per sviluppare trattamenti per altri tumori che presentano specifici difetti nella riparazione del DNA associati al tumore.
