Nuove pubblicazioni
Come un embrione "morde" il tessuto materno: la meccanica dell'impianto negli esseri umani filmata in tempo reale per la prima volta
Ultima recensione: 23.08.2025

Tutti i contenuti di iLive sono revisionati o verificati da un punto di vista medico per garantire la massima precisione possibile.
Abbiamo linee guida rigorose in materia di sourcing e colleghiamo solo a siti di media affidabili, istituti di ricerca accademici e, ove possibile, studi rivisti dal punto di vista medico. Nota che i numeri tra parentesi ([1], [2], ecc.) Sono link cliccabili per questi studi.
Se ritieni che uno qualsiasi dei nostri contenuti sia impreciso, scaduto o comunque discutibile, selezionalo e premi Ctrl + Invio.
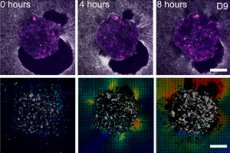
Scienziati di Barcellona (IBEC, Dexeus Mujer) e Tel Aviv hanno mostrato per la prima volta in tempo reale e in 3D come un embrione umano si attacca alla "struttura uterina" e letteralmente tira e ristruttura il tessuto circostante. Per fare questo, hanno creato una piattaforma ex vivo deformabile (gel di collagene/ECM) e hanno applicato la microscopia a forza di trazione direttamente a embrioni umani e di topo viventi. La scoperta chiave: il modello di forze è specie-specifico e gli embrioni stessi sono meccanosensibili: rispondono a stimoli meccanici esterni ristrutturando il citoscheletro e modificando l'orientamento della crescita.
Contesto dello studio
L'impianto è il "collo di bottiglia" della riproduzione umana: è in questa fase che sia i concepimenti naturali sia i tentativi di fecondazione in vitro falliscono più spesso. Allo stesso tempo, l'impianto umano è interstiziale: l'embrione non si "attacca" semplicemente, ma è completamente incorporato nell'endometrio - un processo biochimicamente e meccanicamente complesso, ma fino a poco tempo fa quasi non osservato nei sistemi viventi dell'uomo. Pertanto, i meccanismi di adesione e invasione sono rimasti una "scatola nera" e le conclusioni sono state spesso tratte sulla base di marcatori indiretti o dati provenienti da modelli animali.
La biologia classica dell'impianto si è basata in larga misura sul topo, ma esistono differenze fondamentali tra le specie, dall'orientamento della blastocisti alla profondità dell'impianto e al modello delle forze cellulari. Nei topi, l'impianto è più "superficiale", con direzioni preferenziali di spostamento dei tessuti; negli esseri umani, è nettamente invasivo, con forze di trazione multifocali attorno all'embrione. Queste differenze suggeriscono che il modello murino non sempre sia scalabile per l'uomo, soprattutto per quanto riguarda la meccanica. Sono state necessarie osservazioni dirette dell'embrione umano in un ambiente deformabile.
Questa svolta tecnologica è stata resa possibile dalla combinazione di matrici deformabili 2D/3D (collagene/ECM) e microscopia a forza di trazione con imaging ad alta frequenza a lungo termine. Questo "utero artificiale" ha permesso di vedere e misurare letteralmente come l'embrione tira, ristruttura e "perfora" il tessuto circostante, e come risponde a stimoli meccanici esterni (meccanosensibilità). Ciò apre la strada a nuovi criteri per la valutazione del potenziale di impianto e per la messa a punto delle condizioni del trasferimento embrionale.
Il contesto è applicato: se le proprietà meccaniche dell'ambiente e il modello delle forze embrionali sono associati al successo dell'impianto, allora nella fecondazione in vitro è possibile selezionare in modo mirato la rigidità/composizione della matrice, tenere conto delle finestre temporali del trasferimento e persino utilizzare metriche di "forza" come ulteriore indicatore di selezione. Parallelamente, tali piattaforme contribuiranno a spiegare la percentuale di perdite precoci di gravidanza, quando la biochimica è "normale", ma la meccanica dell'adesione non lo è. Tutto ciò rende le osservazioni 3D dirette dell'impianto umano non solo un bel video, ma un nuovo strumento per la medicina riproduttiva.
Perché è importante?
Il fallimento dell'impianto è una delle principali cause di infertilità e fino al 60% degli aborti spontanei. Nonostante i progressi biochimici nella fecondazione in vitro, la meccanica di questo processo negli esseri umani è rimasta una "scatola nera". Un nuovo approccio ci permette di osservare le forze e le traiettorie dell'impianto embrionale e fornisce una base per migliorare la selezione e le condizioni di trasferimento degli embrioni.
Come è stato fatto
I ricercatori hanno assemblato un "utero artificiale", un ambiente morbido, trasparente e deformabile in cui una matrice simile a un tessuto si sposta visibilmente sotto l'influenza delle forze embrionali. Successivamente, sono state effettuate analisi microscopiche continue e computazionali degli spostamenti delle fibre.
- Piattaforme 2D e 3D: nella 3D, l'embrione viene immediatamente inserito nella matrice (la fase di attacco viene "saltata"), il che consente di vedere la perforazione nello spessore del tessuto.
- Elevata "sopravvivenza e penetrazione" in 3D: circa l'80% di invasione riuscita (limitata dalla vicinanza al vetro).
- Le mappe di trazione e la correlazione digitale del volume mostrano le ampiezze e le direzioni degli spostamenti attorno all'embrione, essenzialmente una "stampa" della forza nel tempo.
Cosa è stato trovato esattamente (brevemente e punto per punto)
1) Meccanica di impianto specie-specifica
- Umano: l'embrione viene inserito nella matrice, creando molteplici focolai di trazione e formando spostamenti radialmente uniformi attorno a sé; la profondità di invasione arriva fino a 200 µm.
- Topo: l'embrione si diffonde principalmente sulla superficie con direzioni di spostamento principali pronunciate.
2) L'embrione percepisce la meccanica dell'ambiente
- Forze esterne → risposta: nell'embrione umano - reclutamento della miosina e pseudopodi cellulari diretti; nel topo - rotazione dell'asse di impianto/crescita verso la fonte della forza esterna (orientamento dell'asse PD).
- Marcatori meccanosensibili: nel topo, spostamenti nella localizzazione di YAP nel trofoblasto; nel complesso, ciò indica un circuito di feedback meccanosensibile.
3) La relazione tra forza e successo dell'impianto
- Minore spostamento del collagene → peggiori progressi nell'impianto negli embrioni umani.
- Integrine: l'"accoppiatore" della forza: il blocco del peptide RGD/inibizione di Src nei topi riduce la profondità/area di impianto.
Come si svolge l'implementazione?
- Sulle piattaforme 2D e 3D, attorno all'embrione si forma un "alone" crescente di spostamenti delle fibre; la mappa di trazione pulsa come se l'embrione stesse "scansionando" l'ambiente circostante.
- Sul vetro, l'embrione umano forma un'escrescenza piatta, ma in una matrice morbida rimane più sferico e si spinge più in profondità, come nei tessuti viventi.
Cosa comporta questo per la pratica (prospettive per la fecondazione in vitro e non solo)
L'idea è semplice: l'impianto non riguarda solo la "chimica del recettore", ma anche la meccanica dell'adesione e della trazione. Questo significa che possiamo ottimizzare:
- Materiali e durezza media durante i test di potenziale colturale/impianto;
- Nuovi marcatori per la selezione degli embrioni - basati sulle traiettorie e sull'ampiezza degli spostamenti nella matrice "intelligente";
- Allenamento/modulazione uterina (ad esempio tramite delicati segnali meccanici) per migliorare l'aderenza senza interventi aggressivi.
Attenzione: il lavoro ex vivo non è "dentro l'utero". Ma il fatto stesso che un segnale meccanico esterno modifichi l'orientamento dell'impianto/organizzazione degli assi apre la strada a condizioni personalizzate di trasferimento embrionale.
Restrizioni
- Il modello ex vivo non tiene conto delle dinamiche immunitarie, ormonali e vascolari dell'endometrio reale;
- Il matrigel/collagene definisce un insieme di proprietà (rigidità, viscoelasticità, composizione), è difficile modificarle con un parametro;
- I vincoli etici per gli studi sull'uomo (finestra fino a 14 giorni) limitano l'osservazione a lungo termine. Tuttavia, l'elevata concordanza con le modalità di impianto in vivo note (interstiziale nell'uomo vs. superficiale nei topi) aumenta la fiducia nel modello.
Conclusione
L'embrione umano "tira" e "perfora" attivamente il tessuto materno, e gli stimoli meccanici provenienti dall'ambiente possono riconfigurarne il comportamento. Il modello di forze e la strategia di impianto sono diversi negli esseri umani e nei topi, e questo potrebbe spiegare perché il modello murino non sempre predice il successo dell'impianto negli esseri umani. La meccanica è ormai un fattore a pieno titolo nell'embriologia precoce e nella medicina riproduttiva.
Fonte: Godeau AL et al. La forza di trazione e la meccanosensibilità mediano modelli di impianto specie-specifici negli embrioni umani e di topo. Science Advances 11(33): eadr5199 (15 agosto 2025). DOI: 10.1126/sciadv.adr519
