Nuove pubblicazioni
L'intelligenza artificiale rileva il cancro alla prostata in fase iniziale, ignorato dai patologi
Ultima recensione: 23.08.2025

Tutti i contenuti di iLive sono revisionati o verificati da un punto di vista medico per garantire la massima precisione possibile.
Abbiamo linee guida rigorose in materia di sourcing e colleghiamo solo a siti di media affidabili, istituti di ricerca accademici e, ove possibile, studi rivisti dal punto di vista medico. Nota che i numeri tra parentesi ([1], [2], ecc.) Sono link cliccabili per questi studi.
Se ritieni che uno qualsiasi dei nostri contenuti sia impreciso, scaduto o comunque discutibile, selezionalo e premi Ctrl + Invio.
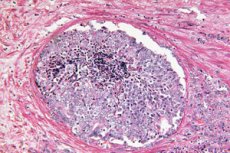
Scientific Reports dimostra che l'intelligenza artificiale è in grado di riconoscere indizi morfologici nascosti di tumore nelle biopsie prostatiche, precedentemente considerate benigne da un patologo. Un modello di deep learning addestrato utilizzando l'approccio debolmente supervisionato ha previsto quali uomini con PSA elevato avrebbero sviluppato un cancro alla prostata clinicamente significativo (ISUP > 1) nei successivi 30 mesi e quali sarebbero rimasti liberi dal cancro per almeno 8 anni. Questo apre le porte a una stratificazione precoce del rischio subito dopo una biopsia iniziale "pulita" e può aiutare a decidere chi necessita realmente di procedure invasive ripetute e di una sorveglianza rafforzata.
Contesto dello studio
L'agobiopsia primaria della prostata produce spesso risultati falsi negativi: una percentuale significativa di tumori clinicamente significativi rimane "off-screen", soprattutto con la tradizionale biopsia TRUS sistematica. L'introduzione della guida RM ha aumentato la percentuale di rilevamento di tumori clinicamente significativi e ridotto il numero di procedure ripetute non necessarie, ma anche con le strategie moderne, alcuni tumori aggressivi rimangono non rilevati. Il dilemma clinico rimane lo stesso: chi dovrebbe essere osservato dopo una biopsia "pulita" e chi dovrebbe essere indirizzato a una biopsia ripetuta precocemente, per non ritardare la diagnosi e non sovraccaricare i pazienti con interventi invasivi.
La base biologica per risolvere questo problema è il fenomeno TINT (tumor-instructed/indicating normal tissue): un tumore "riconfigura" i tessuti circostanti apparentemente normali dell'organo, lasciandovi tracce deboli ma sistematiche, dal rimodellamento stromale all'ipossia, fino alle alterazioni metaboliche. Questi cambiamenti sono stati descritti in modelli sperimentali e in pazienti con cancro alla prostata e sono correlati all'aggressività del tumore, il che rende il tessuto "normale" una potenziale fonte di segnali diagnostici, anche in assenza di ghiandole cancerose evidenti nel campione bioptico.
La patologia digitale e i metodi di deep learning mirano a estrarre queste caratteristiche di campo "sottili" dalle sezioni H&E standard. A differenza della morfologia classica, che si concentra sulle strutture tumorali evidenti, gli algoritmi possono catturare pattern distribuiti nello stroma e nell'epitelio associati alla presenza di un tumore in un'altra parte dell'organo. Questo apre la strada alla stratificazione del rischio immediatamente dopo una biopsia negativa: un "punteggio" di vetro elevato suggerisce l'opportunità di una biopsia ripetuta precocemente o di una guida RM, mentre un punteggio basso supporta un'osservazione più delicata.
Questa è l'idea alla base di un nuovo studio pubblicato su Scientific Reports: gli autori hanno testato se l'intelligenza artificiale possa predire un cancro alla prostata clinicamente significativo nei successivi 30 mesi sulla base di indizi morfologici provenienti da biopsie TINT. Il lavoro si basa su una preprint precedentemente presentata e costituisce una base applicata per l'implementazione di biomarcatori digitali "sul campo" nel percorso di cura dei pazienti dopo una biopsia iniziale "pulita".
Come è stato fatto: progettazione, dati, algoritmo
Gli autori hanno raccolto retrospettivamente una coorte di 232 uomini con PSA elevato e una conclusione iniziale di "benigno" alla biopsia con ago (dopo il controllo tecnico, 213 pazienti e 587 sezioni sono stati inclusi nell'analisi finale; biopsie 1997-2016, Umea, Svezia). Ogni paziente è stato abbinato a una coppia "specchio" per età, anno di diagnosi e livello di PSA: a metà è stato diagnosticato un cancro alla prostata in seguito (≤30 mesi), l'altra metà è rimasta libera da cancro per almeno 8 anni. I vetrini H&E sono stati digitalizzati (20x), tagliati in tessere da 256x256 pixel e inseriti in CLAM (Clustering-constrained Attention Multiple-Instance Learning), un moderno schema debolmente supervisionato, in cui è noto solo il destino del paziente e non la marcatura di ciascun pixel. Le caratteristiche sono state estratte da ResNet18 pre-addestrato su 57 set di dati istopatologici. L'endpoint è binario: basso rischio (benigno/ISUP1) vs. alto rischio (ISUP2-5).
Precisione della previsione
In un test indipendente, il modello ha raggiunto un'AUC di 0,81 su tutti i vetrini e un'AUC di 0,82 a livello di paziente. A una soglia che forniva un equilibrio accettabile, la sensibilità era di 0,92 con un tasso di falsi positivi di 0,32 (a livello di paziente). In altre parole, tra i pazienti la cui biopsia iniziale "non ha funzionato", l'IA ha segnalato correttamente la stragrande maggioranza di coloro a cui è stata presto confermata la presenza di un tumore clinicamente significativo, sebbene a costo di alcuni falsi allarmi. Per la clinica, questo è un segnale: risposta bioptica "benigna" ≠ rischio zero, e può essere stratificato quantitativamente tramite vetro digitale.
Cosa esattamente l'intelligenza artificiale "nota" nei tessuti "normali"?
L'interpretazione tramite UMAP e mappe dell'attenzione ha mostrato che i cambiamenti stromali sono i più informativi:
- Più collagene nello stroma (compattazione della matrice, “fibrosi”);
- Meno cellule muscolari lisce attorno alle ghiandole;
- Meno comuni sono i segnali sottili nell'epitelio ghiandolare, probabilmente al di sotto della risoluzione di downsampling disponibile.
Questo schema rientra nel concetto TINT (tumour-instructed/indicating normal tissue): anche la "norma" in un organo in cui è nascosto un tumore viene riconfigurata sotto la sua influenza e differisce dalla "norma" in un organo senza tumore. Il cancro non è solo un nido, ma anche un campo, e l'intelligenza artificiale impara a interpretare l'effetto di campo.
Come l'approccio è utile nella pratica - scenari potenziali
- Nuova biopsia basata sul rischio: alto tasso di IA su vetro "pulito" - argomento a favore di una nuova biopsia precoce o di una guida MRI invece di aspettare.
- Personalizzazione del monitoraggio: la bassa velocità controbilancia l'ansia dopo una risonanza magnetica "borderline" e consente di moderare l'intensità del monitoraggio.
- Addestramento al modello TINT: le mappe dell'attenzione e le sovrapposizioni interattive aiutano i patologi a vedere i campi sottili attorno al cancro, migliorando la coerenza dei referti.
È importante comprendere i limiti
Si tratta di un singolo centro nella Svezia settentrionale (popolazione prevalentemente caucasica), il disegno è retrospettivo, le biopsie basali sono state eseguite senza guida RM (biopsie TRUS sistematiche) e i marcatori sono risultati futuri piuttosto che "tumore occulto sullo stesso vetrino". Non esiste ancora una validazione esterna presso centri/scanner indipendenti, né esiste uno studio prospettico sull'effetto dell'algoritmo sulle decisioni cliniche e sui risultati. Il tasso di falsi positivi rimane significativo: il modello non sostituisce il medico, ma aggiunge un livello probabilistico per un processo decisionale condiviso.
Cosa c'è dopo: Roadmap di implementazione
- Validazione esterna multicentrica (scanner, protocolli, gruppi etnici diversi).
- Studi decisionali prospettici: il punteggio AI modifica la traiettoria del paziente (tempo di diagnosi, numero di biopsie ripetute non necessarie, diagnosi eccessiva/insufficiente)?
- Integrazione con risonanza magnetica e clinica: modelli combinati (PSA, risonanza magnetica PIRADS, fattori clinici + punteggio TINT secondo H&E).
- Fasi tecniche: standardizzazione della digitalizzazione, controllo della deriva dei dati, spiegabilità (sovrapposizioni di attenzione per la routine).
Fonte: Chelebian E., Avenel C., Järemo H., Andersson P., Bergh A., Wählby C., et al. Scoperta di un tumore che indica cambiamenti morfologici nelle biopsie prostatiche benigne tramite IA. Scientific Reports (Nature Portfolio), pubblicato il 21 agosto 2025. DOI: https://doi.org/10.1038/s41598-025-15105-6
