Nuove pubblicazioni
Celiachia: nuove evidenze sugli effetti del glutine
Ultima recensione: 02.07.2025

Tutti i contenuti di iLive sono revisionati o verificati da un punto di vista medico per garantire la massima precisione possibile.
Abbiamo linee guida rigorose in materia di sourcing e colleghiamo solo a siti di media affidabili, istituti di ricerca accademici e, ove possibile, studi rivisti dal punto di vista medico. Nota che i numeri tra parentesi ([1], [2], ecc.) Sono link cliccabili per questi studi.
Se ritieni che uno qualsiasi dei nostri contenuti sia impreciso, scaduto o comunque discutibile, selezionalo e premi Ctrl + Invio.

Oggi è la Giornata Mondiale della Celiachia. La celiachia è una malattia autoimmune cronica che colpisce circa l'1% della popolazione mondiale. È causata dal consumo di glutine, le proteine contenute in grano, orzo, segale e alcuni tipi di avena. Una dieta senza glutine protegge i pazienti celiaci da gravi danni intestinali.
Insieme ai suoi colleghi, la chimica Dott.ssa Veronica Dodero dell'Università di Bielefeld è riuscita a determinare nuovi dettagli su come alcune molecole derivate dal glutine causino la sindrome dell'intestino permeabile nella celiachia.
La scoperta chiave dello studio: un certo frammento proteico prodotto nella celiachia attiva forma nanostrutture chiamate oligomeri e si accumula nelle cellule epiteliali intestinali modello. Il nome tecnico di questa molecola è peptide di gliadina deamidato 33-mer (DGP). Il team di ricerca ha scoperto che la presenza di oligomeri di DGP può aprire la mucosa intestinale ermeticamente chiusa, causando la sindrome dell'intestino permeabile.
Lo studio è stato pubblicato sulla rivista Angewandte Chemie International Edition.
Peptidi del grano che causano la sindrome dell'intestino permeabile
Quando mangiamo grano, il nostro organismo non è in grado di scomporre completamente le proteine del glutine. Questo può portare alla formazione di grandi frammenti di glutine (peptidi) nell'intestino. Nei casi di celiachia attiva, i ricercatori hanno scoperto che un enzima chiamato transglutaminasi tissutale 2 (tTG2), presente negli esseri umani, modifica uno specifico peptide del glutine, con conseguente formazione di 33-mer DGP. Questo si verifica solitamente in una parte del nostro intestino chiamata lamina propria. Tuttavia, studi recenti hanno dimostrato che questo processo può verificarsi anche nella mucosa intestinale.
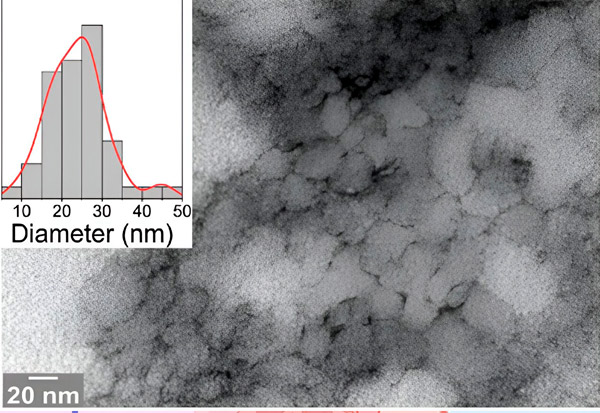
Una micrografia elettronica dello studio mostra il problematico peptide 33-mer DGP con strutture affilate in grado di aprire la barriera intestinale. Fonte: Università di Bielefeld
"Il nostro team interdisciplinare ha caratterizzato la formazione di oligomeri di DGP a 33-mer utilizzando microscopia ad alta risoluzione e metodi biofisici. Abbiamo riscontrato una maggiore permeabilità in un modello di cellule intestinali in seguito all'accumulo di DGP", ha affermato la Dott.ssa Maria Georgina Herrera, prima autrice dello studio. È ricercatrice presso l'Università di Buenos Aires in Argentina e ha svolto un post-dottorato presso l'Università di Bielefeld.
Quando la barriera intestinale è interrotta
La sindrome dell'intestino permeabile si verifica quando la mucosa intestinale diventa permeabile, consentendo a sostanze nocive di entrare nel flusso sanguigno, causando risposte infiammatorie e varie malattie. Nel caso della celiachia, si discute sulle fasi iniziali dell'aumento della permeabilità. La teoria principale è che l'infiammazione cronica nella celiachia porti alla sindrome dell'intestino permeabile.
Tuttavia, esiste una seconda teoria che suggerisce che gli effetti del glutine sulle cellule della mucosa intestinale ne siano la causa principale. Secondo questa teoria, il glutine danneggia direttamente le cellule della mucosa intestinale, rendendole permeabili, causando infiammazione cronica e potenzialmente portando alla celiachia negli individui predisposti.
Tuttavia, poiché il glutine viene consumato quotidianamente, quali sono i fattori molecolari che causano la permeabilità intestinale nei pazienti affetti da celiachia? La formazione di oligomeri di 33-mer DGP può danneggiare la rete cellulare epiteliale, consentendo ai peptidi del glutine, ai batteri e ad altre tossine di riversarsi in massa nel flusso sanguigno, causando infiammazione e, nel caso della celiachia, una risposta autoimmune.
"I nostri risultati rafforzano l'ipotesi medica secondo cui la rottura della barriera epiteliale causata dai peptidi del glutine è la causa e non il risultato della risposta immunitaria nei pazienti affetti da celiachia", afferma l'autrice principale, la Dott.ssa Veronica Dodero del Dipartimento di Chimica dell'Università di Bielefeld.
Collegamento tra 33-mer DGP e celiachia
Gli antigeni leucocitari umani (HLA) sono proteine presenti sulla superficie delle cellule del corpo. Svolgono un ruolo importante nel sistema immunitario, aiutandolo a distinguere tra cellule proprie e sostanze estranee come batteri o virus.
Nel caso della celiachia, due specifiche proteine HLA, ovvero HLA-DQ2 e HLA-DQ8, sono fortemente associate alla malattia. Il DGP a 33 mer si adatta perfettamente a HLA-DQ2 o HLA-DQ8 e innesca una risposta immunitaria che porta a infiammazione e atrofia dei villi intestinali. Questa forte interazione trasforma il DGP in quello che gli scienziati chiamano un superantigene. Per chi soffre di celiachia, una dieta senza glutine è l'unica terapia permanente.
