Nuove pubblicazioni
Il farmaco LM11A-31 rallenta la progressione della malattia di Alzheimer nella sperimentazione
Ultima recensione: 02.07.2025

Tutti i contenuti di iLive sono revisionati o verificati da un punto di vista medico per garantire la massima precisione possibile.
Abbiamo linee guida rigorose in materia di sourcing e colleghiamo solo a siti di media affidabili, istituti di ricerca accademici e, ove possibile, studi rivisti dal punto di vista medico. Nota che i numeri tra parentesi ([1], [2], ecc.) Sono link cliccabili per questi studi.
Se ritieni che uno qualsiasi dei nostri contenuti sia impreciso, scaduto o comunque discutibile, selezionalo e premi Ctrl + Invio.

In uno studio recente pubblicato sulla rivista Nature Medicine, gli scienziati hanno condotto uno studio di fase 2a randomizzato, in doppio cieco, controllato con placebo per esaminare la sicurezza e l'efficacia di LM11A-31 nel trattamento del morbo di Alzheimer (MA) attraverso la modulazione del recettore della neurotrofina p75 (p75NTR).
L'AD a esordio tardivo è la forma più comune di demenza, caratterizzata da insufficienza sinaptica, degenerazione e perdita di cellule nervose. Sebbene i due principali farmaci per il trattamento dell'AD mirino all'accumulo di proteine amiloide-β o tau anomale, essi agiscono solo su una parte della fisiopatologia. Un altro approccio prevede il targeting di recettori e reti di segnalazione che influenzano vie biologiche fondamentali. Studi preclinici dimostrano che la modulazione di p75NTR con una nuova piccola molecola chimica, LM11A-31, riduce la perdita sinaptica causata da amiloide e tau anomala.
Descrizione dello studio
In questo studio clinico randomizzato, i ricercatori hanno esaminato se LM11A-31 potesse rallentare la progressione del morbo di Alzheimer modulando p75NTR negli esseri umani.
Ai partecipanti allo studio sono state somministrate capsule orali di LM11A-31 a dosi di 200 mg e 400 mg oppure placebo in un rapporto 1:1:1 a 242 pazienti con asma lieve o moderato per 26 settimane. I partecipanti avevano la malattia di Alzheimer confermata biologicamente (livello di proteina β-amiloide 42 (Aβ42) nel liquido cerebrospinale inferiore a 550 ng/L o rapporto Aβ42:β40 inferiore a 0,89) diagnosticata secondo i criteri di McKhann, con punteggi al Mini-Psychiatric Examination (MMSE) da 18 a 26, punteggi alla Geriatric Depression Scale (GDS) inferiori a 5,0, punteggi alla Hachinski Ischemic Scale (HIS) modificata ≤ 4,0, istruzione formale ≥ 8 anni e precedente declino cognitivo ≥ 6 mesi.
I partecipanti idonei avevano assunto inibitori dell'acetilcolinesterasi (AChEI) o antagonisti parziali del recettore NMDA per ≥ 3 mesi prima dell'ingresso nello studio. Non assumevano droghe illecite come antipsicotici, benzodiazepine, farmaci antiepilettici, sedativi, antipertensivi ad azione centrale, nootropi (ad eccezione del ginkgo biloba) o analgesici contenenti oppioidi.
L'esito primario dello studio era la sicurezza e la tollerabilità, valutate utilizzando la Columbia Suicidal Thoughts and Behavior Severity Rating Scale (C-SSRS), i parametri vitali, la pressione arteriosa e i parametri ematologici. La risonanza magnetica strutturale (cMRI), la tomografia a emissione di positroni con fluorodesossiglucosio (FDG-PET) e i biomarcatori del liquido cerebrospinale (CSF) sono stati utilizzati per valutare gli esiti cognitivi secondari. Le misure di AD includevano la tau fosforilata da Thr181, la proteina tau totale, Aβ40, Aβ42 e l'attività dell'AChE. Il team ha utilizzato un test neuropsicologico personalizzato per valutare gli esiti cognitivi secondari al basale, alle settimane 12 e 26.
Risultati della ricerca
Lo studio ha dimostrato che LM11A-31 è sicuro e ben tollerato, senza significative problematiche di sicurezza. Gli eventi avversi più comuni includevano cefalea, diarrea, eosinofilia e nasofaringite, con problemi gastrointestinali ed eosinofilia come principali cause di interruzione del trattamento. Si sono verificate più interruzioni nel gruppo trattato con 400 mg rispetto ai gruppi trattati con 200 mg e placebo. La risonanza magnetica non ha evidenziato problematiche di sicurezza, comprese anomalie correlate all'amiloide. Non sono state rilevate differenze significative nei punteggi cognitivi o nelle anomalie amiloidi tra i due gruppi di trattamento.
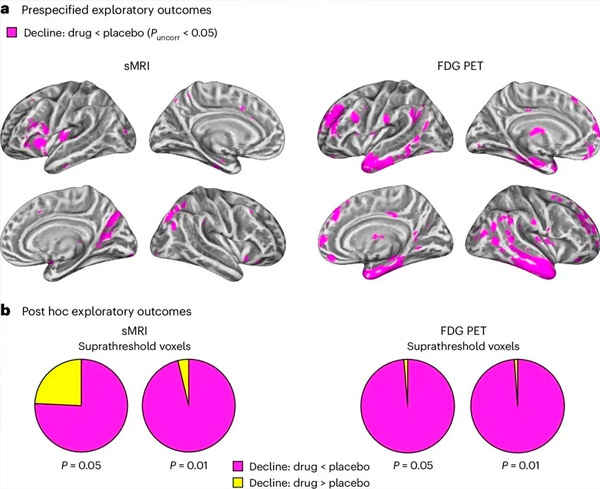
A. L'analisi della covarianza con modelli misti bidirezionali ha esaminato le interazioni tra trattamento (farmaco o placebo) e tempo (pre o post-trattamento). Un t-contrast unilaterale che esaminava l'ipotesi di interazione (il farmaco rallenta la progressione rispetto al placebo) ha mostrato che il trattamento con LM11A-31 ha rallentato la degenerazione longitudinale (riquadri a sinistra) e l'ipometabolismo del glucosio (riquadri a destra) nel gruppo trattato con il farmaco (cMRI, n = 127; PET, n = 121) rispetto al gruppo placebo (cMRI, n = 66; PET, n = 62). I voxel che mostrano questa interazione sono mostrati a una soglia non corretta di P < 0,05 (magenta) su una superficie corticale specifica per la popolazione. Gli emisferi sinistro e destro sono mostrati rispettivamente nelle righe superiore e inferiore. Le regioni cerebrali che mostrano interazioni incoerenti con l'ipotesi sono mostrate nella Figura 7 dei Dati Supplementari.
B. Numero totale di voxel nelle regioni cerebrali AD vulnerabili predefinite (area totale dei grafici a torta) che mostrano un'interazione in linea con l'ipotesi (magenta) o un'interazione incoerente con l'ipotesi (giallo) in ciascuna modalità di imaging (cMRI, pannello sinistro; FDG PET, pannello destro) a soglie progressivamente più ampie di P non corretto < 0,01 e P < 0,05. Le simulazioni Monte Carlo hanno mostrato che i rapporti tra voxel che mostravano effetti in linea con l'ipotesi e incoerenti con l'ipotesi erano significativamente più alti di quelli osservati sulla base di dati generati casualmente sia per cMRI che per PET (P < 0,001 per ciascuna modalità; test a due code).
LM11A-31 ha ridotto efficacemente l'aumento di Aβ42 e Aβ40 nel liquido cerebrospinale rispetto al gruppo placebo. Il farmaco ha inoltre mostrato una riduzione della variazione percentuale annua mediana del biomarcatore proteico presinaptico SNAP25 e una diminuzione del biomarcatore postsinaptico NG, indicando un rallentamento della perdita di connessioni presinaptiche e postsinaptiche. LM11A-31 ha inoltre ridotto l'aumento di YKL40, portando a una diminuzione dei punteggi MMSE e a un aumento dei punteggi ADAS-Cog-13. Il farmaco ha inoltre ridotto la perdita di materia grigia nel lobo frontale e nella corteccia parietale posteriore e una diminuzione del metabolismo del glucosio in aree come la corteccia entorinale, la corteccia temporale, l'ippocampo, la corteccia insulare e la corteccia prefrontale.
Conclusione
Lo studio ha concluso che la modulazione di p75NTR da parte di LM11A-31 è adatta a studi clinici più ampi. LM11A-31 ha raggiunto l'endpoint primario di sicurezza ed è stato ben tollerato nei pazienti con AD da lieve a grave. I risultati indicano la necessità di ulteriori studi con durate di trattamento più lunghe per valutare il potenziale delle piccole molecole di regolare p75NTR come terapia modificante la malattia nell'AD. Lo studio ha dimostrato che LM11A-31 ha influenzato significativamente diversi biomarcatori, tra cui Aβ40, Aβ42, SNAP25, NG e YKL40, indicando un rallentamento della progressione patologica. Studi futuri potrebbero valutare ulteriori indicatori di salute gliale.
