Nuove pubblicazioni
La mutazione del gene ARID1A rende i tumori sensibili all'immunoterapia
Ultima recensione: 14.06.2024

Tutti i contenuti di iLive sono revisionati o verificati da un punto di vista medico per garantire la massima precisione possibile.
Abbiamo linee guida rigorose in materia di sourcing e colleghiamo solo a siti di media affidabili, istituti di ricerca accademici e, ove possibile, studi rivisti dal punto di vista medico. Nota che i numeri tra parentesi ([1], [2], ecc.) Sono link cliccabili per questi studi.
Se ritieni che uno qualsiasi dei nostri contenuti sia impreciso, scaduto o comunque discutibile, selezionalo e premi Ctrl + Invio.
L'immunoterapia ha rivoluzionato il trattamento del cancro negli ultimi anni. Invece di colpire direttamente i tumori, l’immunoterapia indirizza il sistema immunitario dei pazienti ad attaccare i tumori in modo più efficace. Ciò è particolarmente efficace per alcuni tumori difficili da trattare. Tuttavia, meno della metà di tutti i pazienti affetti da cancro risponde alle attuali immunoterapie, creando l'urgente necessità di identificare biomarcatori in grado di prevedere quali pazienti hanno maggiori probabilità di trarre beneficio dal trattamento.
Recentemente, gli scienziati hanno notato che i pazienti i cui tumori presentano una mutazione del gene ARID1A hanno maggiori probabilità di rispondere positivamente al blocco del checkpoint immunitario, un tipo di immunoterapia che funziona. Mantenendo attivate le cellule immunitarie che combattono il cancro.
Poiché la mutazione del gene ARID1A è presente in molti tumori, tra cui quelli dell'endometrio, dell'ovaio, del colon-retto, dello stomaco, del fegato e del pancreas, i ricercatori del Salk Institute si sono chiesti come potrebbe contribuire alla sensibilità del trattamento e in che modo i medici potrebbero utilizzare queste informazioni per personalizzare il cancro trattamento per ogni paziente.
Il loro nuovo studio, pubblicato sul journal Cell, mostra che la mutazione ARID1A rende i tumori sensibili all'immunoterapia reclutando cellule immunitarie che combattono il cancro nel tumore attraverso una risposta immunitaria. Simile all'antivirale.
I ricercatori suggeriscono che questa mutazione e la risposta immunitaria antivirale potrebbero essere utilizzate come biomarcatore per selezionare meglio i pazienti per immunoterapie specifiche, come il blocco dei checkpoint immunitari. Questi risultati incoraggiano anche lo sviluppo di farmaci che prendono di mira ARID1A e le proteine ad esso associate per rendere altri tumori più sensibili all'immunoterapia.
"Ciò potrebbe davvero cambiare l'esito del trattamento del cancro per i pazienti", afferma la professoressa associata Diana Hargreaves, autrice senior dello studio. "I pazienti con la mutazione ARID1A hanno già una risposta immunitaria, quindi tutto ciò che dobbiamo fare è potenziare tale risposta con il blocco dei checkpoint immunitari per aiutarli a distruggere i loro tumori dall'interno."
Sebbene fosse noto che le persone con mutazioni di ARID1A rispondevano bene al blocco del checkpoint immunitario, l'esatta relazione tra i due rimaneva poco chiara. Per chiarire il meccanismo di questo processo, gli scienziati del Salk Institute hanno utilizzato modelli murini di melanoma e cancro del colon-retto con una mutazione ARID1A e ARID1A funzionale.
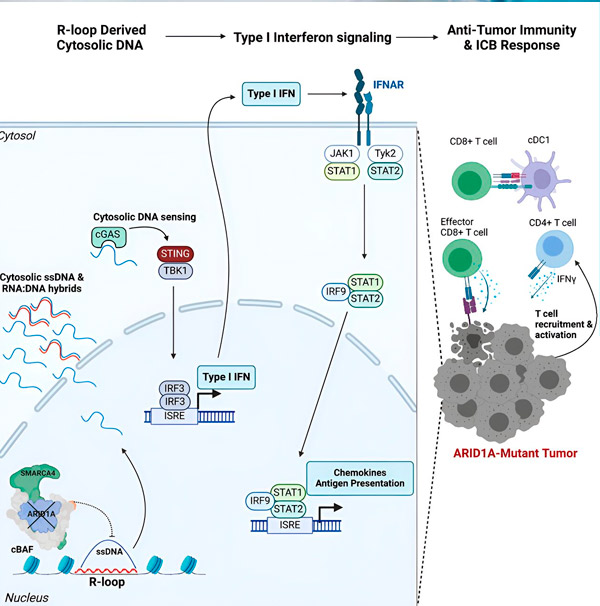
Fonte: Cell (2024). DOI: 10.1016/j.cell.2024.04.025
Il team ha osservato una potente risposta immunitaria in tutti i modelli con la mutazione ARID1A, ma non in quelli in cui ARID1A era funzionale, supportando l'idea che la mutazione ARID1A sia effettivamente alla base di questa risposta. Ma come funziona a livello molecolare?
"Abbiamo scoperto che ARID1A svolge un ruolo importante nel nucleo mantenendo la corretta organizzazione del DNA", afferma Matthew Maxwell, primo autore dello studio e dottorando presso il laboratorio di Hargreaves. "Senza ARID1A funzionale, il DNA libero può essere asportato e rilasciato nel citosol, attivando la risposta immunitaria antivirale desiderata, che può essere potenziata dal blocco del checkpoint immunitario."
Il gene ARID1A codifica per una proteina che aiuta a regolare la forma del nostro DNA e a mantenere la stabilità del genoma. Quando ARID1A muta, nelle cellule tumorali viene attivata una catena di eventi simile a una macchina di Rube Goldberg.
Inizialmente, l'assenza di ARID1A funzionale determina il rilascio di DNA nel citosol. Il DNA citosolico attiva quindi un sistema di allarme antivirale, il percorso cGAS-STING, poiché le nostre cellule sono adattate a contrassegnare qualsiasi DNA nel citosol come estraneo per proteggersi dalle infezioni virali. In definitiva, il percorso cGAS-STING recluta il sistema immunitario per reclutare cellule T nel tumore e le attiva in cellule T specializzate killer del cancro.
Ad ogni passaggio, a seconda del precedente, questa catena di eventi (mutazione di ARID1A, fuga del DNA, allarme cGAS-STING, reclutamento di cellule T) determina un aumento del numero di cellule T che combattono il cancro nel tumore. Il blocco dei checkpoint immunitari può quindi essere utilizzato per garantire che queste cellule T rimangano attivate, migliorando la loro capacità di sconfiggere il cancro.
"I nostri risultati forniscono un nuovo meccanismo molecolare mediante il quale la mutazione ARID1A può contribuire alla risposta immunitaria antitumorale", afferma Hargreaves. "La cosa più entusiasmante di questi risultati è il loro potenziale traslazionale. Possiamo utilizzare le mutazioni di ARID1A per selezionare i pazienti per il blocco dei checkpoint immunitari e ora stiamo vedendo un meccanismo mediante il quale i farmaci che inibiscono ARID1A o il suo complesso proteico potrebbero essere utilizzati per migliorare ulteriormente l'immunoterapia in altri pazienti."
Descrivendo il meccanismo attraverso il quale il blocco del checkpoint immunitario è più efficace per i tumori con una mutazione ARID1A, i ricercatori forniscono ai medici una motivazione logica per dare priorità a questa immunoterapia per i pazienti con una mutazione ARID1A. Questi risultati rappresentano un passo importante nella personalizzazione del trattamento del cancro e ispirano lo sviluppo di nuove terapie volte a inibire ARID1A e il suo complesso proteico.
In futuro, il team del Salk Institute spera che i risultati possano migliorare i risultati per i pazienti con vari tipi di cancro associati alle mutazioni di ARID1A e intende esplorare questa traduzione clinica in collaborazione con l'Università della California, a San Diego. p>
