Nuove pubblicazioni
"Ossigeno per le cellule": un semplice impianto ha aiutato ad abbassare i livelli di zucchero senza farmaci potenti
Ultima recensione: 18.08.2025

Tutti i contenuti di iLive sono revisionati o verificati da un punto di vista medico per garantire la massima precisione possibile.
Abbiamo linee guida rigorose in materia di sourcing e colleghiamo solo a siti di media affidabili, istituti di ricerca accademici e, ove possibile, studi rivisti dal punto di vista medico. Nota che i numeri tra parentesi ([1], [2], ecc.) Sono link cliccabili per questi studi.
Se ritieni che uno qualsiasi dei nostri contenuti sia impreciso, scaduto o comunque discutibile, selezionalo e premi Ctrl + Invio.
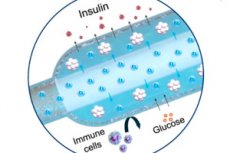
Un nuovo impianto di "ossigeno" per il trattamento del diabete di tipo 1 è stato descritto su Nature Communications: un generatore elettrochimico di ossigeno (iEOG) compatto che fornisce costantemente O₂ a una macrocapsula contenente cellule secernenti insulina. Questo sistema consente un impacchettamento compatto di isole isolate (fino a 60.000 IEQ/ml) e ne mantiene la vitalità e la secrezione anche in condizioni di scarsa ossigenazione. Nei ratti diabetici, il dispositivo impiantato sottocute ha mantenuto livelli glicemici normali fino a tre mesi, senza immunosoppressione. I ratti di controllo, in assenza di ossigeno, sono rimasti iperglicemici.
Sfondo
- Il principale problema tecnico è l'ossigeno. Non appena "nasconderemo" le cellule dietro la membrana e inseriamo il dispositivo sotto la pelle (estraendolo in modo comodo e semplice), esse rimarranno prive di ossigeno: la diffusione attraverso la membrana e la scarsa vascolarizzazione non soddisferanno le esigenze delle isole "voraci". Da qui la morte precoce, la scarsa funzionalità e la necessità di diradare notevolmente la semina, altrimenti la capsula risulterebbe enorme.
- Perché è così fisicamente difficile? L'ossigeno attraversa i tessuti solo per distanze molto brevi e le cellule incapsulate non hanno vasi sanguigni propri: per i primi mesi vivono solo per diffusione passiva. Qualsiasi ispessimento dei materiali o "compattazione" delle cellule trasferisce rapidamente il centro della capsula all'ipossia.
- Cosa hai provato prima?
- Hanno realizzato macrodispositivi ricaricabili di ossigeno (ad esempio, βAir): al loro interno è presente un serbatoio che viene rifornito di ossigeno quotidianamente; sono stati condotti studi preclinici e clinici preliminari. Funziona, ma richiede molto lavoro per il paziente.
- Sono stati sperimentati donatori chimici di O₂ e materiali "vettori" (composti perfluoro): sono utili, ma hanno un effetto breve e difficile da controllare. Sono comparsi anche telai "ad aria" per accelerare il rilascio di O₂ nello spessore del gel.
- Le capsule stesse e i siti di impianto (membrane sottili, prevascolarizzazione) sono stati migliorati, ma senza una fonte esterna di O₂ si scontrano ancora con i limiti di densità cellulare.
- Quale lacuna nel puzzle colma il nuovo lavoro? Gli autori di Nature Communications mostrano un apporto continuo di ossigeno da un mini-generatore direttamente all'interno del sistema di macroincapsulazione: il dispositivo preleva acqua dai tessuti e rilascia elettrochimicamente O₂, che "respira" uniformemente lungo la capsula contenente le cellule. L'idea è quella di dotare la capsula di un proprio "compressore d'acquario" in modo che possa stipare più cellule e mantenerle comunque vive e funzionanti, anche in un ambiente sottocutaneo, poco "ossigenato".
Perché è necessario tutto questo?
Il trapianto di isole pancreatiche o cellule beta è una delle strade più promettenti per una "cura funzionale" del diabete di tipo 1. Ma ci sono due ostacoli principali:
- Immunità: di solito richiede immunosoppressori per tutta la vita;
- Mancanza di ossigeno: le capsule che proteggono il sistema immunitario separano simultaneamente le cellule dai vasi, e le cellule beta, voraci di O₂, "soffocano" rapidamente. Il nuovo studio colpisce la seconda barriera: fornisce alla capsula una fonte di ossigeno controllata e autonoma.
Come funziona l'impianto
- Due parti. In una custodia di titanio è presente un mini-generatore di ossigeno (iEOG), che estrae acqua dal fluido interstiziale e rilascia O₂ per elettrolisi; accanto ad esso si trova una sottile capsula lineare con cellule (simile a una lunga "salsiccia"), attraverso la quale passa un tubo permeabile ai gas: l'ossigeno viene assorbito uniformemente lungo tutta la capsula. Tra le cellule e i tessuti è presente una membrana semipermeabile (elettrospin + alginato): glucosio e insulina passano, le cellule immunitarie no.
- Dimensioni: la seconda versione di iEOG ha un diametro di 13 mm e uno spessore di 3,1 mm, per un peso di circa 2 g. Se abbinato a una capsula, questo sistema può essere inserito e rimosso attraverso una piccola incisione, il che è importante per la sicurezza.
- Produttività. Il generatore produce circa 1,9–2,3 cm³ di O₂/h e mantiene il flusso specificato per mesi e persino anni (in test a lungo termine in soluzione salina, fino a 2,5 anni); dopo l'impianto nei ratti, questo livello è stato mantenuto. Si calcola che tale flusso soddisfi il fabbisogno di centinaia di migliaia di equivalenti di isole, l'ordine di grandezza di cui ha bisogno una persona.
Cosa hanno mostrato gli esperimenti
- In vitro: all'1% di O₂ (grave ipossia), l'ossigenazione ha mantenuto la vitalità e la secrezione negli aggregati INS-1 e negli isolotti umani impacchettati in uno strato molto denso (60.000 IEQ/mL).
- In vivo (ratti). Dopo l'impianto sottocutaneo in un modello di diabete allogenico, il sistema iEOG ha normalizzato la glicemia fino a 3 mesi senza immunosoppressione; i dispositivi senza ossigeno non hanno avuto alcun effetto. L'istologia attorno al generatore non ha mostrato reazioni avverse significative.
Perché questo è importante per la clinica?
- Un passo verso "dimensioni realistiche". Per fornire a un adulto una dose di 300-770 mila IEQ, la capsula deve essere ben compattata, un limite che è sempre stato imposto dall'ossigeno. L'apporto controllato di O₂ "elimina il limite" alla densità e offre la possibilità di rendere il dispositivo sufficientemente compatto per un impianto reale.
- Più praticità. In precedenza, abbiamo provato i donatori chimici di ossigeno (perossidi), che non hanno un'efficacia prolungata e sono incontrollabili, così come le riserve di O₂ con "rifornimento" giornaliero attraverso la pelle, scomode e scomode. Con questo, l'ossigeno viene fornito costantemente e in dosi misurate, senza iniezioni.
Dettagli tecnici che impressionano
- La fonte di acqua è il tessuto. L'iEOG assorbe il vapore del fluido interstiziale attraverso una "finestra" porosa, quindi un classico sistema membrana-elettrodo (MEA) e una tensione di 1,4-1,8 V vengono utilizzati per separare l'acqua in H₂ e O₂; i gas vengono rimossi attraverso canali diversi.
- Durata. Tre dispositivi in soluzione salina hanno funzionato per 11 mesi, 2 anni e 2,5 anni a corrente continua senza degradazione dovuta al flusso di ossigeno; dopo l'impianto in ratti immunodeficienti e immunocompetenti, le prestazioni sono state mantenute.
Limitazioni e "cosa succederà dopo"
Siamo ancora in fase preclinica: ratti, alta densità nella capsula, apporto di ossigeno: tutto è perfetto, ma i test chiave devono ancora venire:
- adattamento alle dosi e ai tempi umani;
- affidabilità e alimentazione degli elettrochimici nel corpo umano da anni (l'architettura dell'alimentazione non è dettagliata nell'articolo);
- minimizzazione della fibrosi attorno alle capsule e stabilità della diffusione;
- Test su cellule staminali beta e su modelli più simili all'uomo. Gli autori confrontano apertamente la loro soluzione con approcci precedenti e la propongono come piattaforma per capsule clinicamente traducibili.
Conclusione
Affinché le cellule beta trapiantate possano vivere e funzionare senza immunosoppressori, devono respirare. Il team di Cornell e dei suoi partner ha dimostrato che un mini-generatore di ossigeno integrato in una capsula lineare può "nutrire" le cellule con O₂ per un tempo sufficientemente lungo e uniforme da consentire loro di resistere ad alte densità e ridurre gli zuccheri anche in sede sottocutanea. La clinica è ancora lontana, ma la logica ingegneristica è semplice e affascinante: dare aria alle cellule dove manca.
