Nuove pubblicazioni
Identificata una proteina chiave per prevenire la perdita di massa ossea nell'osteoporosi
Ultima recensione: 02.07.2025

Tutti i contenuti di iLive sono revisionati o verificati da un punto di vista medico per garantire la massima precisione possibile.
Abbiamo linee guida rigorose in materia di sourcing e colleghiamo solo a siti di media affidabili, istituti di ricerca accademici e, ove possibile, studi rivisti dal punto di vista medico. Nota che i numeri tra parentesi ([1], [2], ecc.) Sono link cliccabili per questi studi.
Se ritieni che uno qualsiasi dei nostri contenuti sia impreciso, scaduto o comunque discutibile, selezionalo e premi Ctrl + Invio.
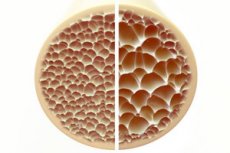
L'osteoporosi, una condizione caratterizzata da ossa porose e fragili, rappresenta una minaccia significativa per la salute scheletrica. Le ossa, in quanto principale supporto strutturale del corpo umano, forniscono un supporto vitale. Una diminuzione della massa ossea non solo compromette questo supporto, ma compromette anche la funzionalità complessiva, con conseguente peggioramento della qualità della vita.
Con l'aumento dell'incidenza dell'osteoporosi nella popolazione anziana, aumenta il carico di risorse sanitarie per l'assistenza a lungo termine. È quindi necessario comprendere i meccanismi che contribuiscono allo sviluppo dell'osteoporosi e sviluppare trattamenti mirati ed efficaci per minimizzarne l'impatto a lungo termine.
Osteoblasti e osteoclasti sono due tipi di cellule che svolgono un ruolo chiave nel mantenimento e nel rimodellamento del tessuto osseo. Mentre gli osteoblasti sono cellule deputate alla formazione dell'osso, responsabili della sintesi e della deposizione di nuovo tessuto osseo, gli osteoclasti sono cellule deputate alla degradazione e alla rimozione del tessuto osseo vecchio o danneggiato.
Un aumento della percentuale di osteoclasti porta alla perdita di tessuto osseo in condizioni come l'osteoporosi, l'artrite reumatoide (infiammazione delle articolazioni) e le metastasi ossee (tumore che si è diffuso alle ossa). Gli osteoclasti derivano dalla differenziazione di macrofagi o monociti, che sono tipi di cellule immunitarie.
Pertanto, l'inibizione della differenziazione degli osteoclasti può fungere da strategia terapeutica per prevenire la perdita ossea. Tuttavia, i precisi meccanismi molecolari che regolano il complesso processo di rimodellamento osseo rimangono poco chiari.
In un nuovo studio, il Professor Tadayoshi Hayata, il Sig. Takuto Konno e la Sig.ra Hitomi Murachi della Tokyo University of Science, insieme ai loro colleghi, hanno approfondito la regolazione molecolare della differenziazione degli osteoclasti. La stimolazione con il ligando dell'attivatore del recettore del fattore nucleare kappa B (RANKL) induce la differenziazione dei macrofagi in osteoclasti.
Inoltre, le vie di segnalazione della proteina morfogenetica ossea (BMP) e del fattore di crescita trasformante (TGF)-β sono state implicate nella regolazione della differenziazione degli osteoclasti mediata da RANKL. Nel presente studio, i ricercatori si sono prefissati di indagare il ruolo di Ctdnep1, una fosfatasi (un enzima che rimuove i gruppi fosfato) che è stata segnalata come in grado di sopprimere le vie di segnalazione di BMP e TGF-β.
Lo studio è pubblicato sulla rivista Biochemical and Biophysical Research Communications.
Il professor Hayata afferma: "RANKL agisce come un 'acceleratore' per la differenziazione degli osteoclasti. Guidare un'auto richiede non solo un acceleratore, ma anche i freni. In questo caso, abbiamo scoperto che Ctdnep1 agisce come un 'freno' nella differenziazione degli osteoclasti."
I ricercatori hanno inizialmente esaminato l'espressione di Ctdnep1 nei macrofagi di topo trattati con RANKL e nelle cellule di controllo non trattate. Hanno osservato che l'espressione di Ctdnep1 non cambiava in risposta alla stimolazione con RANKL. Tuttavia, era localizzata nel citoplasma dei macrofagi in forma granulare e si differenziava in osteoclasti, a differenza della sua normale localizzazione perinucleare in altri tipi cellulari, a indicare la sua funzione citoplasmatica nella differenziazione degli osteoclasti.
Inoltre, l'inibizione di Ctdnep1 (downregulation dell'espressione genica) ha determinato un aumento del numero di osteoclasti positivi alla fosfatasi acida resistente al tartrato (TRAP), dove TRAP è un marcatore degli osteoclasti differenziati.
Il knockout di Ctdnep1 ha portato a un aumento dell'espressione di marcatori chiave della differenziazione, tra cui "Nfatc1", un fattore di trascrizione principale indotto da RANKL per la differenziazione degli osteoclasti. Questi risultati supportano l'ipotesi di una "funzione freno" di Ctdnep1, che regola negativamente la differenziazione degli osteoclasti. Inoltre, il knockout di Ctdnep1 ha portato anche a un aumento dell'assorbimento di fosfato di calcio, suggerendo un ruolo soppressivo di Ctdnep1 nel riassorbimento osseo.
Infine, sebbene il knockout di Ctdnep1 non abbia alterato la segnalazione di BMP e TGF-β, le cellule con deficit di Ctdnep1 hanno mostrato livelli aumentati di proteine fosforilate (attivate), che sono prodotti della via di segnalazione di RANKL. Questi risultati suggeriscono che l'effetto inibitorio di Ctdnep1 sulla differenziazione degli osteoclasti potrebbe non essere mediato dalla segnalazione di BMP e TGF-β, ma dalla downregulation della via di segnalazione di RANKL e dai livelli della proteina Nfatc1.
Nel complesso, questi risultati forniscono nuove informazioni sul processo di differenziazione degli osteoclasti e identificano potenziali bersagli terapeutici che potrebbero essere utilizzati per sviluppare trattamenti volti a ridurre la perdita ossea dovuta all'iperattività degli osteoclasti. Oltre alle malattie caratterizzate da perdita ossea, Ctdnep1 è stato anche identificato come fattore causale nel medulloblastoma, un tumore cerebrale infantile. Gli autori sono ottimisti sul fatto che la loro ricerca possa essere estesa ad altre patologie umane oltre al metabolismo osseo.
Il professor Hayata conclude: "I nostri risultati suggeriscono che Ctdnep1 sia necessario per prevenire un'eccessiva osteoclastogenesi. Questi risultati potrebbero ampliare ulteriormente le nostre conoscenze su come la rete di fosforilazione-defosforilazione controlla la differenziazione degli osteoclasti e potrebbero fornire nuove strategie terapeutiche per il trattamento delle patologie ossee associate a un'eccessiva attività degli osteoclasti".
