Esperto medico dell'articolo
Nuove pubblicazioni
Cause e patogenesi della difterite
Ultima recensione: 04.07.2025

Tutti i contenuti di iLive sono revisionati o verificati da un punto di vista medico per garantire la massima precisione possibile.
Abbiamo linee guida rigorose in materia di sourcing e colleghiamo solo a siti di media affidabili, istituti di ricerca accademici e, ove possibile, studi rivisti dal punto di vista medico. Nota che i numeri tra parentesi ([1], [2], ecc.) Sono link cliccabili per questi studi.
Se ritieni che uno qualsiasi dei nostri contenuti sia impreciso, scaduto o comunque discutibile, selezionalo e premi Ctrl + Invio.
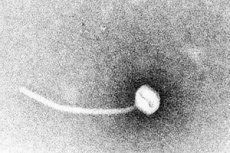
La difterite è un esempio paradigmatico di malattia infettiva tossigena. Nel 1883, Klebs dimostrò che il Corynebacterium diphtheriae era l'agente eziologico della difterite. Un anno dopo, Loeffler scoprì che l'organismo poteva essere coltivato solo dalla cavità nasofaringea e propose che il danno agli organi interni fosse dovuto a una tossina solubile. Nel 1888, Roux e Yersin dimostrarono che gli animali iniettati con filtrati sterili di C. diphtheriae sviluppavano una patologia d'organo indistinguibile da quella della difterite umana; ciò dimostrò che una potente esotossina era il principale fattore di virulenza.
La difterite è spesso un'infezione delle vie respiratorie superiori che causa febbre, mal di gola e malessere. Una spessa membrana di fibrina grigio-verde, una pseudomembrana, si forma spesso nel sito/nei siti di infezione a causa dell'effetto combinato della crescita batterica, della produzione di tossine, della necrosi tissutale sottostante e della risposta immunitaria dell'ospite. Il riconoscimento che il danno d'organo sistemico è dovuto all'azione della tossina difterica ha portato allo sviluppo sia di una terapia efficace a base di antitossina per il trattamento dell'infezione acuta, sia di un vaccino tossoide altamente efficace.
Sebbene la vaccinazione con tossoide abbia reso la difterite una malattia rara nelle aree in cui gli standard di sanità pubblica richiedono la vaccinazione, epidemie di difterite si verificano ancora in gruppi non immunizzati e immunodepressi. Al contrario, epidemie diffuse di difterite, che hanno raggiunto proporzioni epidemiche, si sono verificate in aree in cui i programmi di immunizzazione attiva sono stati sospesi.
Altri tipi di corinebatteri
Oltre a C. diphtheriae, C. ulcerans e C. pseudotuberculosis, anche C. pseudodiphtheriticum e C. xerosis possono occasionalmente causare infezioni nasofaringee e cutanee. Questi ultimi due ceppi sono riconoscibili per la loro capacità di produrre pirazinamide. In medicina veterinaria, C. renale e C. kutscheri sono importanti patogeni, causando rispettivamente pielonefrite nei bovini e infezioni latenti nei topi.
Le cause
L'agente eziologico della difterite, il Corynebacterium diphtheriae, è un bastoncino sottile, leggermente ricurvo, con ispessimenti a forma di clava alle estremità, immobile; non forma spore, capsule o flagelli ed è Gram-positivo.
Oltre alla tossina, i corinebatteri della difterite producono durante i loro processi vitali neuraminidasi, ialuronidasi, emolisina, fattori necrotizzanti e diffusi, che possono causare necrosi e liquefazione della sostanza principale del tessuto connettivo.
In base alla loro capacità di formare tossine, i corinebatteri della difterite si dividono in tossigeni e non tossigeni.
La tossina difterica è una potente esotossina batterica che determina le manifestazioni cliniche sia generali che locali della malattia. La tossigenicità è determinata geneticamente. I corinebatteri non tossigeni della difterite non causano la malattia.
In base alle caratteristiche culturali e morfologiche, tutti i corinebatteri della difterite sono suddivisi in 3 varianti: gravis, mitis, intermedius. Non vi è alcuna dipendenza diretta della gravità della malattia dalla variante di corinebatteri della difterite. Ogni variante contiene ceppi sia tossigeni che non tossigeni. I corinebatteri tossigeni di tutte le varianti producono una tossina identica. [ 1 ]
Struttura, classificazione e tipi di antigeni
Corynebacterium diphtheriae è un batterio Gram-positivo, immobile, a forma di bastoncino. I ceppi che crescono nei tessuti o in colture in vitro più vecchie contengono piccole macchie nelle pareti cellulari che consentono la decolorazione durante la colorazione di Gram e determinano una reazione di Gram variabile. Le colture più vecchie contengono spesso granuli metacromatici (polimetafosfato) che si colorano di blu-viola con blu di metilene. Gli zuccheri della parete cellulare includono arabinosio, galattosio e mannosio. Inoltre, è possibile isolare il tossico 6,6'-estere del trealosio, contenente acidi corinemicolico e corinemicolenico in concentrazioni equimolari. Si riconoscono tre distinti tipi di coltura: mitis, intermedius e gravis.
La maggior parte dei ceppi richiede acido nicotinico e pantotenico per la crescita; alcuni richiedono anche tiamina, biotina o acido pimelico. Per una produzione ottimale di tossina difterica, il terreno di coltura deve essere arricchito con aminoacidi e messo da parte.
Già nel 1887, Loeffler descrisse l'isolamento di ceppi avirulenti (non tossigeni) di C. diphtheriae, indistinguibili dai ceppi virulenti (tossigeni) isolati da pazienti in individui sani. Oggi è riconosciuto che i ceppi avirulenti di C. diphtheriae possono essere convertiti in un fenotipo virulento a seguito di infezione e lisogenizzazione da parte di uno dei numerosi corinebatteriofagi distinti che trasportano il gene strutturale per la tossina difterica, tox. La conversione lisogena del fenotipo avirulento in virulento può verificarsi sia in situ che in vitro. Il gene strutturale per la tossina difterica non è essenziale né per il corinebatteriofago né per C. diphtheriae. Nonostante questa osservazione, non è stata osservata alcuna deriva genetica della tossina difterica.
Patogenesi
Le vie d'ingresso dell'infezione sono le mucose dell'orofaringe, del naso, della laringe, meno frequentemente le mucose degli occhi e dei genitali, nonché la pelle lesa, le superfici di ferite o ustioni, l'eritema da pannolino e la ferita ombelicale non cicatrizzata. Nel punto d'ingresso, il corinebatterio difterico si moltiplica e secerne esotossina.
L'essudato ricco di fibrinogeno viene essudato e convertito in fibrina sotto l'azione della trombochinasi rilasciata durante la necrosi delle cellule epiteliali. Si forma una pellicola fibrinosa, segno caratteristico della difterite.
La portabilità nasofaringea asintomatica è comune nelle regioni endemiche per la difterite. Negli individui suscettibili, i ceppi tossigeni causano la malattia replicandosi e secernendo la tossina difterica nel rinofaringe o nelle lesioni cutanee. La lesione difterica è spesso ricoperta da una pseudomembrana composta da fibrina, batteri e cellule infiammatorie. La tossina difterica può essere scissa proteoliticamente in due frammenti: il frammento A N-terminale (dominio catalitico) e il frammento B (domini transmembrana e di legame al recettore). Il frammento A catalizza l'ADP-ribosilazione NAD+-dipendente del fattore di allungamento 2, inibendo così la sintesi proteica nelle cellule eucariotiche. Il frammento B si lega a un recettore di superficie cellulare e facilita il rilascio del frammento A nel citosol.
L'immunità protettiva comporta la risposta anticorpale alla tossina difterica dopo la malattia clinica o alla tossina difterica (tossina inattivata dalla formaldeide) dopo l'immunizzazione.
Colonizzazione
Si sa poco sui fattori che mediano la colonizzazione di C. diphtheriae. Tuttavia, è chiaro che fattori diversi dalla produzione di tossina difterica contribuiscono alla virulenza. Studi epidemiologici hanno dimostrato che un dato lisotipo può persistere in una popolazione per lunghi periodi di tempo. Può successivamente essere sostituito da un altro lisotipo. L'emergere e la successiva dominanza di un nuovo lisotipo in una popolazione sono presumibilmente correlate alla sua capacità di colonizzare e competere efficacemente nel suo segmento della nicchia ecologica nasofaringea. Corynebacterium diphtheriae può produrre neuraminidasi, che scinde l'acido sialico di superficie cellulare nei suoi componenti piruvato e acido N-acetilneuraminico. Il fattore cordonale (6,6'-di-O-micoloil-α, α'-D-trealosio) è un componente di superficie di C. diphtheriae, ma il suo ruolo nella colonizzazione dell'ospite umano non è chiaro.
Produzione di tossine difteriche
Il gene strutturale della tossina difterica, tox, appartiene a una famiglia di corinebatteriofagi strettamente correlati, di cui il β-fago è il più studiato. La regolazione dell'espressione della tossina difterica è mediata da un repressore attivato dal ferro, DtxR, codificato dal genoma di C. diphtheriae. L'espressione della tossina dipende dallo stato fisiologico di C. diphtheriae. In condizioni in cui il ferro diventa il substrato limitante la velocità di crescita, il ferro si dissocia da DtxR, il gene toxicodendron si attiva e la tossina difterica viene sintetizzata e secreta nel terreno di coltura a velocità massima.
La tossina difterica è insolitamente potente; per le specie sensibili (ad esempio esseri umani, scimmie, conigli, porcellini d'India) anche una dose di soli 100-150 ng/kg di peso corporeo è letale. La tossina difterica è costituita da una singola catena polipeptidica di 535 amminoacidi. Analisi biochimiche, genetiche e strutturali a raggi X mostrano che la tossina è composta da tre domini strutturali/funzionali:
- ADP-ribosiltransferasi N-terminale (dominio catalitico);
- una regione che facilita il passaggio del dominio catalitico attraverso la membrana cellulare (dominio transmembrana);
- dominio di legame del recettore delle cellule eucariotiche.
Dopo una lieve digestione con tripsina e riduzione in condizioni denaturanti, la tossina difterica può essere scissa specificamente a livello del suo anello proteasi-sensibile in due frammenti polipeptidici (A e B). Il frammento A è il componente N-terminale di 21 kDa della tossina e contiene il sito catalitico per l'ADP-ribosilazione del fattore di allungamento 2 (EF-2).
Diagramma a nastro della struttura cristallina a raggi X della tossina difterica nativa monomerica (modificato da Bennett MJ, Choe S, Eisenberg D: Domain swapping: Entangleling aliances between proteins. Proc Natl Acad Sci, USA, 91: 3127, 1994). Sono mostrate le posizioni relative dei domini catalitico, transmembrana e di legame al recettore. La tossina intatta può essere scissa da proteasi tripsino-simili in Arg190, Arg192 e/o Arg193, che si trovano nell'ansa proteasi-sensibile (PSL). In seguito alla riduzione del ponte disolfuro tra Cys186 e Cys201, la tossina può essere risolta in frammenti A e B. Sono mostrati l'estremità amminica (N) e quella carbossi-terminale (C) della tossina intatta. Il diagramma a nastro è stato creato utilizzando il programma MOLESCRIPT.
Il frammento C-terminale, frammento B, trasporta i domini transmembrana e di legame al recettore della tossina.
L'avvelenamento di una singola cellula eucariotica da parte della tossina difterica comporta almeno quattro fasi distinte:
- legame della tossina al suo recettore sulla superficie cellulare;
- raggruppamento di recettori carichi in fossette rivestite e internalizzazione della tossina tramite endocitosi mediata dal recettore; in seguito all'acidificazione della vescicola endocitica da parte di una pompa protonica associata alla membrana e guidata da ATP,
- inserimento del dominio transmembrana nella membrana e facilitazione del rilascio del dominio catalitico nel citosol, e
- ADP-ribosilazione di EF-2, con conseguente soppressione irreversibile della sintesi proteica.
È stato dimostrato che una singola molecola del dominio catalitico immessa nel citosol è sufficiente a risultare letale per la cellula.
Rappresentazione schematica dell'intossicazione da difterite di una cellula eucariotica suscettibile.
La tossina si lega al suo recettore sulla superficie cellulare e viene internalizzata tramite endocitosi mediata dal recettore; dopo l'acidificazione dell'endosoma, il dominio transmembrana viene inserito nella membrana della vescicola; il dominio catalitico viene consegnato al citosol, causando l'inibizione della sintesi proteica e la morte cellulare.
Epidemiologia
Prima dell'immunizzazione di massa della popolazione statunitense con il tossoide difterico, la difterite era solitamente una malattia infantile. Un aspetto degno di nota dell'immunizzazione di massa con il tossoide difterico è che all'aumentare della percentuale di popolazione con livelli protettivi di immunità antitossinica (≥ 0,01 UI/mL), la frequenza di isolamento di ceppi tossigeni nella popolazione diminuisce. Oggi, negli Stati Uniti, dove la difterite clinica è quasi completamente scomparsa, l'isolamento di ceppi tossigeni di C. diphtheriae è raro. Poiché l'infezione subclinica non fornisce più una fonte di esposizione all'antigene difterico e, a meno che non venga somministrato un richiamo, l'immunità all'antitossina diminuisce, un'ampia percentuale di adulti (dal 30 al 60%) presenta livelli di antitossina inferiori ai livelli protettivi ed è a rischio. Negli Stati Uniti, in Europa e nell'Europa orientale, recenti epidemie di difterite si sono verificate principalmente tra individui che abusano di alcol e/o droghe. All'interno di questo gruppo, i portatori di C. diphtheriae tossigena presentano un livello di immunità antitossica moderatamente elevato. La recente interruzione delle misure di sanità pubblica in Russia ha portato la difterite a diventare un'epidemia. Alla fine del 1994, in Russia erano stati segnalati più di 80.000 casi e più di 2.000 decessi.
Le epidemie focali di difterite sono quasi sempre associate a un portatore immune che è tornato da una regione in cui la difterite è endemica. Infatti, recenti epidemie di difterite clinica negli Stati Uniti e in Europa sono state associate a viaggiatori di ritorno dalla Russia e dall'Europa orientale. I ceppi tossigeni di C. diphtheriae vengono trasmessi direttamente da persona a persona tramite goccioline trasportate dall'aria. È noto che i ceppi tossigeni possono colonizzare direttamente la cavità nasofaringea. Inoltre, il gene tossigeno può essere diffuso indirettamente attraverso il rilascio di corinebatteriofagi tossigeni e la trasformazione lisogena di C. diphtheriae autoctono non tossigeno in situ. [ 5 ]
Oltre alla determinazione del biotipo e del lisotipo degli isolati di C. diphtheriae, le tecniche di biologia molecolare possono ora essere utilizzate per studiare le epidemie di difterite. I modelli di digestione con endonucleasi di restrizione del DNA cromosomico di C. diphtheriae sono stati utilizzati per studiare le epidemie cliniche, così come l'uso di sequenze di inserzione di corinebatteri clonati come sonda genetica.
Il test di Schick è stato utilizzato per molti anni per valutare l'immunità alla tossina difterica, sebbene sia stato ora sostituito in molte aree dal test sierologico per anticorpi specifici alla tossina difterica. Nel test di Schick, una piccola quantità di tossina difterica (circa 0,8 ng in 0,2 ml) viene iniettata per via intradermica nell'avambraccio (sito del test) e 0,0124 μg di tossina difterica in 0,2 ml vengono iniettati per via intradermica nel sito di controllo. Le letture vengono effettuate a 48 e 96 ore. Le reazioni cutanee aspecifiche raggiungono solitamente il picco a 48 ore. A 96 ore, una reazione eritematosa con possibile necrosi nel sito del test indica un'immunità antitossica insufficiente a neutralizzare la tossina (≤ 0,03 UI/ml). L'infiammazione sia nell'area del test che in quella di controllo dopo 48 ore indica una reazione di ipersensibilità alla preparazione antigenica.
Forme
Il Corynebacterium diphtheriae infetta il rinofaringe o la pelle. I ceppi tossigeni producono una potente esotossina che può causare la difterite. I sintomi della difterite includono faringite, febbre e gonfiore del collo o dell'area circostante la lesione cutanea. Le lesioni difteriche sono ricoperte da una pseudomembrana. La tossina si diffonde attraverso il flusso sanguigno verso organi distanti e può causare paralisi e insufficienza cardiaca congestizia. [ 6 ]
Esistono due tipi di difterite clinica: nasofaringea e cutanea. I sintomi della difterite faringea variano da una lieve faringite all'ipossia dovuta all'ostruzione delle vie aeree da parte di una pseudomembrana. Il coinvolgimento dei linfonodi cervicali può causare un grave gonfiore del collo (difterite del collo del toro) e il paziente può sviluppare febbre (≥ 39 °C). Le lesioni cutanee nella difterite cutanea sono solitamente ricoperte da una pseudomembrana grigio-marrone. Complicanze sistemiche potenzialmente letali, principalmente perdita della funzione motoria (ad esempio, difficoltà a deglutire) e insufficienza cardiaca congestizia, possono svilupparsi a seguito dell'azione della tossina difterica sui motoneuroni periferici e sul miocardio.
Controllare
Il controllo della difterite dipende da un'adeguata immunizzazione con tossoide difterico: tossina difterica inattivata dalla formaldeide, che rimane antigenicamente intatta. Il tossoide viene preparato incubando la tossina difterica con formaldeide a 37 °C in condizioni alcaline. La vaccinazione contro la difterite deve iniziare nel secondo mese di vita con una serie di tre dosi primarie a intervalli di 4-8 settimane, seguite da una quarta dose circa 1 anno dopo l'ultima dose primaria. Il tossoide difterico è ampiamente utilizzato come componente del vaccino contro difterite-pertosse-tetano (DPT). Studi epidemiologici hanno dimostrato che l'immunizzazione contro la difterite ha un'efficacia di circa il 97%. Sebbene l'immunizzazione di massa contro la difterite sia praticata negli Stati Uniti e in Europa e i tassi di vaccinazione infantile siano adeguati, un'ampia percentuale della popolazione adulta può avere titoli anticorpali inferiori ai livelli protettivi. Gli adulti devono essere rivaccinati con tossoide difterico ogni 10 anni. In effetti, una vaccinazione di richiamo con tossoide difterico-tetanico dovrebbe essere somministrata ai viaggiatori che si recano in aree con alti tassi di difterite endemica (America centrale e meridionale, Africa, Asia, Russia ed Europa orientale). Negli ultimi anni, l'uso di preparati a base di tossoide altamente purificato per l'immunizzazione ha ridotto al minimo le occasionali reazioni di ipersensibilità gravi. Una vaccinazione di richiamo con tossoide difterico-tetanico dovrebbe essere somministrata ai viaggiatori che si recano in aree con alti tassi di difterite endemica (America centrale e meridionale, Africa, Asia, Russia ed Europa orientale). Negli ultimi anni, l'uso di preparati a base di tossoide altamente purificato per l'immunizzazione ha ridotto al minimo le occasionali reazioni di ipersensibilità gravi. Una vaccinazione di richiamo con tossoide difterico-tetanico dovrebbe essere somministrata ai viaggiatori che si recano in aree con alti tassi di difterite endemica (America centrale e meridionale, Africa, Asia, Russia ed Europa orientale). Negli ultimi anni, l'uso di preparati a base di tossoidi altamente purificati per l'immunizzazione ha ridotto al minimo le occasionali reazioni di ipersensibilità grave.
Sebbene gli antibiotici (come la penicillina e l'eritromicina) siano utilizzati come parte del trattamento dei pazienti affetti da difterite, l'immunizzazione passiva rapida con antitossina difterica è la più efficace nel ridurre la mortalità. La lunga emivita dell'antitossina specifica nel flusso sanguigno è un fattore importante per garantire un'efficace neutralizzazione della tossina difterica; tuttavia, per essere efficace, l'antitossina deve reagire con la tossina prima che questa possa entrare nella cellula.
Reingegnerizzazione della tossina difterica per lo sviluppo di citotossine specifiche per i recettori eucariotici
L'ingegneria proteica è un campo nuovo e in rapida evoluzione della biologia molecolare; combina metodologie di DNA ricombinante e sintesi di DNA in fase solida per progettare e costruire geni chimerici i cui prodotti presentano proprietà uniche. Studi sulle relazioni struttura-funzione della tossina difterica hanno chiaramente dimostrato che questa tossina è una proteina a tre domini: catalitico, transmembrana e recettoriale. È stato possibile sostituire geneticamente il dominio nativo di legame al recettore della tossina difterica con vari ormoni polipeptidici e citochine (ad esempio, ormone α-melanocita-stimolante [α-MSH], interleuchina (IL) 2, IL-4, IL-6, IL-7, fattore di crescita epidermico). Le proteine chimeriche risultanti, o tossine di fusione, combinano la specificità di legame al recettore della citochina con i domini transmembrana e catalitico della tossina. In ogni caso, è stato dimostrato che le tossine di fusione avvelenano selettivamente solo le cellule che presentano il corrispondente recettore bersaglio. La prima di queste tossine di fusione geneticamente modificate, DAB 389IL-2, è attualmente in fase di valutazione in studi clinici sull'uomo per il trattamento di linfomi refrattari e malattie autoimmuni in cui le cellule con recettori IL-2 ad alta affinità svolgono un ruolo importante nella patogenesi.[ 7 ] La somministrazione di DAB 389IL-2 si è dimostrata sicura, ben tollerata e in grado di indurre una remissione duratura della malattia senza gravi effetti collaterali. È probabile che le tossine di fusione basate sulla tossina difterica diventino nuovi importanti agenti biologici per il trattamento di tumori o malattie specifici in cui possono essere presi di mira specifici recettori di superficie cellulare.


 [
[