Esperto medico dell'articolo
Nuove pubblicazioni
Aborto spontaneo - Cause
Ultima recensione: 04.07.2025

Tutti i contenuti di iLive sono revisionati o verificati da un punto di vista medico per garantire la massima precisione possibile.
Abbiamo linee guida rigorose in materia di sourcing e colleghiamo solo a siti di media affidabili, istituti di ricerca accademici e, ove possibile, studi rivisti dal punto di vista medico. Nota che i numeri tra parentesi ([1], [2], ecc.) Sono link cliccabili per questi studi.
Se ritieni che uno qualsiasi dei nostri contenuti sia impreciso, scaduto o comunque discutibile, selezionalo e premi Ctrl + Invio.
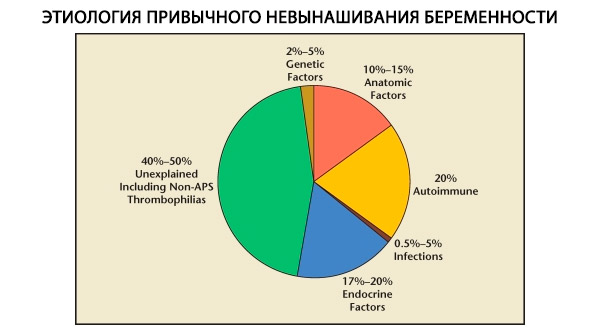
Nella struttura degli aborti spontanei abituali, si distinguono fattori genetici, anatomici, endocrini, immunologici e infettivi. Escludendo tutte le cause sopra menzionate, rimane un gruppo di pazienti in cui l'origine dell'aborto abituale non è chiara (aborti spontanei idiopatici). Secondo C. Coulam et al. (1996), l'80% degli aborti spontanei idiopatici è dovuto a patologie immunitarie non riconosciute.
Non esistono prove convincenti che l'endometriosi causi aborti spontanei ricorrenti o che il trattamento medico o chirurgico dell'endometriosi riduca l'incidenza di aborti spontanei ricorrenti.
Secondo le concezioni attuali, oltre alle cause genetiche e parzialmente infettive che portano alla formazione di un embrione anomalo, l'azione dannosa di altri fattori (anatomici, endocrini, immunologici) consiste nel creare un contesto sfavorevole per lo sviluppo di un ovulo fecondato geneticamente completo, che porta all'esaurimento della capacità di riserva del corion e all'arresto dello sviluppo (embriogenesi). I periodi critici nel primo trimestre di gravidanza sono di 6-8 settimane (morte dell'embrione) e 10-12 settimane (espulsione dell'ovulo fecondato).
 [ 1 ]
[ 1 ]
Cause genetiche dell'aborto spontaneo abituale
I fattori genetici rappresentano il 3-6% delle cause di aborto spontaneo abituale. Nelle interruzioni sporadiche di gravidanza nel primo trimestre, circa il 50% degli aborti presenta anomalie cromosomiche. La maggior parte (95%) di queste è costituita da alterazioni del numero di cromosomi: monosomia (perdita di un cromosoma), trisomia (presenza di un cromosoma in più), che sono il risultato di errori nella meiosi, e poliploidia (aumento della composizione cromosomica con un corredo aploide completo), che si verifica quando un ovulo viene fecondato da due o più spermatozoi. Negli aborti sporadici si riscontra più spesso la trisomia, che costituisce il 60% di tutte le mutazioni (più spesso sul cromosoma 16, ma anche 13, 18, 21, 22), al secondo posto per frequenza si trova la sindrome di Shereshevsky-Turner (cromosoma 45 X0) con il 20%, il restante 15% è dovuto alla poliploidia (soprattutto triploidia).
In caso di alterazione del numero di cromosomi in un aborto, l'esame del cariotipo dei genitori il più delle volte non rivela alcuna patologia e la probabilità di una malattia cromosomica del feto durante una gravidanza successiva è dell'1%. Al contrario, nell'esame degli aborti in coppie con aborto spontaneo abituale, si osservano alterazioni strutturali dei cromosomi (intra- e intercromosomiche) nel 3-6% dei casi. Nell'esame del cariotipo dei genitori, si riscontrano riarrangiamenti cromosomici bilanciati nel 7% dei casi. Si tratta più spesso di traslocazioni reciproche, in cui un segmento di un cromosoma si trova al posto di un altro segmento di un cromosoma non omologo, nonché di mosaicismo dei cromosomi sessuali, inversione e rilevamento di cromosomi a forma di anello. In caso di presenza di tali riarrangiamenti in uno dei coniugi, i processi di appaiamento e separazione dei cromosomi vengono ostacolati durante la meiosi, con conseguente perdita (delezione) o duplicazione di segmenti cromosomici nei gameti. Ciò si traduce nei cosiddetti riarrangiamenti cromosomici sbilanciati, in cui l'embrione risulta non vitale o è portatore di una grave patologia cromosomica. La probabilità di avere un figlio con anomalie cromosomiche sbilanciate in presenza di riarrangiamenti cromosomici bilanciati nel cariotipo di uno dei genitori è dell'1-15%. Le differenze nei dati sono associate alla natura dei riarrangiamenti, alle dimensioni dei segmenti coinvolti, al sesso del portatore e alla storia familiare.
Diagnostica
Anamnesi
- Malattie ereditarie nei membri della famiglia.
- Presenza di anomalie congenite nella famiglia.
- Nascita di bambini con ritardo mentale.
- Presenza di infertilità e/o aborto spontaneo di origine sconosciuta in una coppia sposata o nei parenti.
- Presenza di casi poco chiari di mortalità perinatale.
Metodi di ricerca speciali
- Lo studio del cariotipo dei genitori è particolarmente indicato per le coppie sposate alla nascita di un neonato con difetti dello sviluppo oltre a una storia di aborto spontaneo, nonché nei casi di aborto spontaneo abituale nelle prime fasi della gravidanza.
- Analisi citogenetica dell'aborto nei casi di morte fetale o mortalità neonatale.
Indicazioni per la consultazione con altri specialisti
Se nei genitori vengono rilevate alterazioni del cariotipo, è necessaria una consulenza con un genetista per valutare il grado di rischio di avere un figlio affetto da una patologia o, se necessario, decidere se donare un ovulo o uno spermatozoo.
Ulteriore gestione del paziente
Se una coppia sposata presenta un cariotipo patologico, anche in uno dei genitori, si raccomanda di effettuare una diagnosi prenatale durante la gravidanza (biopsia corionica o amniocentesi), a causa dell'elevato rischio di disturbi dello sviluppo del feto.
Cause anatomiche dell'aborto abituale
Le cause anatomiche dell'aborto spontaneo abituale includono:
- anomalie congenite nello sviluppo dell'utero (sdoppiamento completo dell'utero; utero bicorne, a sella, unicorne; setto intrauterino parziale o completo);
- difetti anatomici acquisiti;
- aderenze intrauterine (sindrome di Asherman);
- fibromi uterini sottomucosi;
- insufficienza istmo-cervicale.
La frequenza di anomalie anatomiche nelle pazienti con aborto spontaneo abituale varia dal 10 al 16%. La frequenza di insorgenza di malformazioni uterine che possono causare aborto spontaneo (ma non infertilità) in relazione a tutte le malformazioni uterine è la seguente: utero bicorne - 37%, utero a sella - 15%, setto intrauterino - 22%, utero sdoppiato completo - 11%, utero unicorne - 4,4%.
Diagnosi di aborto spontaneo abituale
Anamnesi
In caso di patologia anatomica dell'utero si osservano più spesso interruzioni tardive di gravidanza e parti prematuri, tuttavia in caso di impianto sul setto intrauterino o in prossimità del nodo miomatoso sono possibili anche interruzioni precoci di gravidanza.
Nel caso dell'insufficienza istmo-cervicale, il segno patognomonico è l'interruzione spontanea della gravidanza nel secondo trimestre o il parto prematuro, che avviene in tempi relativamente rapidi e con poco dolore.
In caso di malformazioni dell'utero è necessario prestare attenzione alle indicazioni anamnestiche di patologia delle vie urinarie (spesso associate ad anomalie congenite dell'utero) e alla natura dello sviluppo della funzione mestruale (indicazioni di ematometra con corno rudimentale dell'utero funzionante).
Metodi di esame speciali
- Attualmente, l'isterosalpingografia viene eseguita per stabilire una diagnosi, consentendo di studiare la forma della cavità uterina, identificare la presenza di fibromi sottomucosi, aderenze, setti e determinare la pervietà delle tube di Falloppio. Per diagnosticare una patologia uterina, è razionale eseguire l'isterosalpingografia nel periodo tra le mestruazioni e l'ovulazione, ovvero nella prima fase del ciclo mestruale dopo la cessazione delle perdite ematiche (7-9° giorno del ciclo). Per diagnosticare l'insufficienza istmo-cervicale, l'esame viene eseguito nella seconda fase del ciclo mestruale (18-20° giorno) al fine di determinare le condizioni dell'orifizio cervicale interno. Prima di eseguire l'isterosalpingografia, è necessario escludere malattie infiammatorie degli organi pelvici o trattarle.
- L'isteroscopia si è diffusa negli ultimi anni ed è diventata il gold standard per la diagnosi di patologia intrauterina. Tuttavia, a causa del suo costo più elevato rispetto all'isterosalpingografia, il metodo viene utilizzato nelle donne con indicazione di patologia intrauterina sulla base di dati ecografici preliminari. L'isteroscopia può essere utilizzata per esaminare la cavità uterina, determinare la natura della patologia intrauterina e, se è disponibile l'attrezzatura necessaria (resettoscopio), eseguire un trattamento chirurgico mini-invasivo: rimozione di aderenze, linfonodi miomatosi sottomucosi e polipi endometriali. In caso di rimozione di un setto intrauterino, si preferisce l'isteroresectoscopia con controllo laparoscopico, che previene la possibilità di perforazione della parete uterina.
- L'ecografia viene eseguita nella prima fase del ciclo mestruale, consentendo una diagnosi presuntiva di mioma uterino sottomucoso e aderenze intrauterine, e nella seconda fase del ciclo per identificare un setto intrauterino e un utero bicorne. Questo metodo è di particolare importanza nelle fasi iniziali della gravidanza, quando la sua sensibilità nella diagnosi di queste condizioni è del 100% e la sua specificità è dell'80%. Al di fuori della gravidanza, la diagnosi richiede un'ulteriore conferma con altri metodi.
- Autori stranieri sottolineano il vantaggio della sonoisterografia (ecografia con sensore transvaginale e introduzione preliminare di una soluzione di cloruro di sodio allo 0,9% nella cavità uterina) rispetto all'isterosalpingografia, in quanto consente la diagnosi differenziale tra il setto intrauterino e l'utero bicorne. Con la sonoisterografia è possibile non solo studiare la forma della cavità uterina, ma anche determinare la configurazione del fondo uterino. Nel nostro Paese, questa metodica non ha ancora trovato ampia diffusione.
- In alcuni casi complessi, la risonanza magnetica degli organi pelvici viene utilizzata per confermare la diagnosi. Il metodo consente di ottenere informazioni preziose in caso di anomalie dello sviluppo uterino accompagnate da una disposizione atipica degli organi nella pelvi. La risonanza magnetica è importante in caso di corno uterino rudimentale per decidere se sia opportuno rimuoverlo. La necessità di rimuovere il corno uterino rudimentale si verifica in caso di sua connessione con la tuba e l'ovaio per impedire la formazione e lo sviluppo dell'ovulo fecondato al suo interno. L'interruzione di gravidanza in caso di anomalie anatomiche dell'utero può essere associata a un impianto non riuscito dell'ovulo fecondato (sul setto intrauterino, in prossimità del nodo mioma sottomucoso), a una vascolarizzazione e a una ricezione dell'endometrio insufficienti, a stretti rapporti spaziali nella cavità uterina (ad esempio, in caso di deformazione della cavità da parte di un nodo mioma), spesso accompagnate da ICI, e a disturbi ormonali.
Trattamento dell'aborto spontaneo abituale
Trattamento chirurgico
In presenza di setto intrauterino, linfonodi miomatosi sottomucosi e aderenze, il trattamento chirurgico più efficace è l'isteroresectoscopia. La frequenza di aborti spontanei successivi in questo gruppo di donne dopo il trattamento è del 10%, rispetto al 90% prima dell'intervento. Confrontando i risultati della metroplastica eseguita per laparotomia e dell'isteroresectoscopia transcervicale, P. Heinonen (1997) ha ottenuto risultati che indicano un minore trauma e una maggiore efficacia dell'isteroresectoscopia; la percentuale di gravidanze con nascita di bambini vitali è stata rispettivamente del 68% e dell'86%.
La rimozione chirurgica del setto intrauterino, delle aderenze e dei linfonodi miomatosi sottomucosi elimina l'aborto spontaneo nel 70-80% dei casi. Tuttavia, è inefficace nelle donne con malformazioni uterine che hanno avuto parti normali con successivi aborti ricorrenti. È probabile che in questi casi il fattore anatomico non sia la causa principale ed è necessario ricercare altre cause di aborto spontaneo.
È stato dimostrato che la metroplastica addominale è associata a un rischio significativo di infertilità postoperatoria e non migliora la prognosi delle gravidanze successive. Pertanto, è preferibile privilegiare l'isteroscopia e gli interventi laparoscopici.
Trattamento farmacologico
L'efficacia dell'introduzione dello IUD, di dosi elevate di farmaci estrogenici, dell'introduzione di un catetere di Foley nella cavità uterina dopo interventi chirurgici per rimuovere aderenze e del setto intrauterino non è stata dimostrata. Si raccomanda di pianificare una gravidanza non prima di 3 mesi dall'intervento. Per migliorare la crescita dell'endometrio, si esegue una terapia ormonale ciclica per 3 cicli mestruali [14]. Per 3 mesi, nei primi 14 giorni del ciclo, si consiglia di assumere un farmaco contenente 2 mg di 17-beta-estradiolo, nei successivi 14 giorni - 2 mg di 17-beta-estradiolo e 20 mg di didrogesterone (10 mg di didrogesterone come parte di un farmaco combinato più 10 mg di didrogesterone in una compressa separata).
Ulteriore gestione del paziente
Caratteristiche del decorso della gravidanza con utero bicorne o sdoppiamento dell'utero (quando sono presenti 2 cavità uterine):
- nelle prime fasi della gravidanza, spesso si verificano sanguinamenti dal corno "vuoto" o dalla cavità uterina a causa di una pronunciata reazione decidua; la tattica in questo caso dovrebbe essere conservativa e consistere nell'uso di agenti antispasmodici ed emostatici;
- minaccia di interruzione di gravidanza in varie fasi;
- sviluppo di insufficienza istmo-cervicale;
- ritardo della crescita intrauterina dovuto a insufficienza placentare.
Nelle prime fasi della gravidanza, in caso di emorragie, è consigliabile il riposo a letto e semi-letto, la somministrazione di farmaci emostatici, antispastici e sedativi e la terapia con gestageni (didrogesterone in dose giornaliera da 20 a 40 mg) fino alla 16a-18a settimana di gestazione.
Cause endocrine dell'aborto abituale
Secondo diversi autori, le cause endocrine dell'aborto spontaneo rappresentano dall'8 al 20% del totale. Le più significative sono il deficit della fase luteale (LPD), l'ipersecrezione di LH, la disfunzione tiroidea e il diabete mellito.
Una grave patologia tiroidea o il diabete mellito possono portare ad aborti ripetuti. Tuttavia, nel diabete mellito compensato, il rischio di aborti abituali non differisce da quello della popolazione generale.
Allo stesso tempo, l'elevata incidenza di ipotiroidismo nella popolazione richiede uno screening con misurazione dei livelli di TSH. Nelle pazienti con aborto spontaneo abituale, l'insufficienza della fase luteale si osserva nel 20-60% dei casi e i segni ecografici di ovaio policistico nel 44-56%. Secondo la letteratura, l'influenza dei singoli disturbi ormonali sulla formazione del complesso sintomatico dell'aborto spontaneo abituale rimane controversa. Gli studi di M. Ogasawara et al. (1997) non hanno rivelato differenze affidabili nella frequenza di interruzione di gravidanza con e senza LPI in pazienti con due o più aborti spontanei precedenti nell'anamnesi, escludendo cause autoimmuni, anatomiche e infettive.
L'insufficienza della funzionalità del corpo luteo può essere il risultato di una serie di fattori sfavorevoli:
- disturbi nella secrezione di FSH e LH nella prima fase del ciclo mestruale;
- picco precoce o, al contrario, troppo tardivo del rilascio di LH;
- ipoestrogenismo come conseguenza di follicologenesi inadeguata. Tutte queste condizioni non sono soggette a correzione mediante terapia sostitutiva con farmaci progestinici nel periodo postovulatorio. Studi prospettici condotti da L. Regan et al. hanno mostrato un aumento significativo della frequenza di aborti spontanei nelle pazienti con ipersecrezione di LH all'ottavo giorno del ciclo mestruale rispetto alle donne con livelli ematici di LH normali (rispettivamente il 65% e il 12% degli aborti spontanei). L'effetto dannoso di un picco prematuro di LH è associato alla ripresa prematura della seconda divisione meiotica e all'ovulazione di un ovulo immaturo, nonché all'induzione della produzione di androgeni da parte delle cellule della teca insieme a una ridotta ricezione endometriale sotto l'influenza dell'insufficienza progestinica. Tuttavia, la riduzione preliminare dei livelli preovulatori di LH con agonisti dell'ormone di rilascio delle gonadotropine senza misure aggiuntive volte a prolungare la gravidanza successiva non fornisce la riduzione attesa della frequenza di aborti spontanei.
Il gold standard per la diagnosi di NLF è l'esame istologico del materiale ottenuto dalla biopsia endometriale nella seconda fase del ciclo nell'arco di 2 cicli mestruali.
La diagnosi di altre cause di disfunzione ovulatoria, come iperprolattinemia, ipotiroidismo, eccesso funzionale di androgeni (ovarici o surrenalici), deve essere accompagnata dalla prescrizione di un trattamento appropriato.
Diagnostica
Anamnesi ed esame fisico
- Anamnesi. Fattori da considerare: menarca tardivo, ciclo mestruale irregolare (oligomenorrea, amenorrea, aumento di peso improvviso, perdita di peso, infertilità, aborti spontanei precoci abituali).
- Esame: tipologia di corporatura, altezza, peso corporeo, irsutismo, gravità dei caratteri sessuali secondari, presenza di smagliature, esame delle ghiandole mammarie per galattorrea.
- Test diagnostici funzionali: misurazione della temperatura rettale durante 3 cicli mestruali.
Metodi di ricerca speciali
- Studio ormonale:
- nella 1a fase del ciclo mestruale (7°–8° giorno) – determinazione del contenuto di FSH, LH, prolattina, TSH, testosterone, 17-idrossiprogesterone (17-OP), DHEAS;
- nella 2a fase del ciclo mestruale (21-22 giorni) – determinazione del contenuto di progesterone (gli indicatori normativi dei livelli di progesterone sono molto variabili, il metodo non può essere utilizzato senza tenere conto di altri fattori).
- Ultrasuoni:
- nella 1a fase del ciclo mestruale (5°–7° giorno) – diagnosi di patologia endometriale, ovaio policistico;
- nella 2a fase del ciclo mestruale (20-21 giorni) – misurazione dello spessore dell’endometrio (normale 10-11 mm, correlato al contenuto di progesterone).
- Una biopsia endometriale per verificare l'NLF viene eseguita 2 giorni prima della mestruazione prevista (al 26° giorno con un ciclo di 28 giorni). Questo metodo viene utilizzato nei casi in cui la diagnosi non è chiara. Per studiare i cambiamenti dell'endometrio nel cosiddetto periodo di "finestra di impianto", una biopsia viene eseguita il 6° giorno dopo l'ovulazione.
Trattamento
Nella diagnosi di NLF (secondo i grafici della temperatura rettale, la durata della 2a fase è inferiore a 11 giorni, si osserva un aumento graduale della temperatura, insufficiente trasformazione secretoria dell'endometrio secondo i dati della biopsia endometriale, bassi livelli di progesterone nel siero sanguigno), è necessario identificare la causa di tali disturbi.
Se la NLF è accompagnata da iperprolattinemia, viene eseguita una risonanza magnetica cerebrale. Un metodo alternativo è la radiografia del cranio (regione della sella turcica).
Il primo stadio dell'iperprolattinemia consiste nell'escludere un adenoma ipofisario, che richiede un trattamento chirurgico. In assenza di alterazioni significative, l'iperprolattinemia è considerata funzionale e viene prescritto un trattamento con bromocriptina per normalizzare i livelli di prolattina. La dose iniziale di bromocriptina è di 1,25 mg/die per 2 settimane; dopo il monitoraggio dei livelli di prolattina, se gli indicatori non si normalizzano, la dose viene aumentata a 2,5 mg/die. In caso di aumento significativo dei livelli di prolattina, la dose iniziale è di 2,5 mg/die. In caso di gravidanza, la bromocriptina deve essere interrotta.
In caso di ipotiroidismo, la natura della patologia tiroidea viene determinata insieme a un endocrinologo. In ogni caso, è indicata una terapia giornaliera con levotiroxina sodica, il cui dosaggio viene scelto individualmente fino alla normalizzazione del livello di TSH. In caso di gravidanza, il trattamento con levotiroxina sodica deve essere continuato. L'opportunità di aumentare il dosaggio nel primo trimestre di gravidanza viene valutata insieme a un endocrinologo, dopo aver ricevuto i risultati di un esame ormonale (livello di TSH, tiroxina libera).
La correzione dell'NLF può essere effettuata in due modi. Il primo è la stimolazione dell'ovulazione, il secondo è la terapia sostitutiva con preparati di progesterone.
La prima opzione terapeutica è la stimolazione dell'ovulazione con clomifene citrato. Questo metodo terapeutico si basa sul fatto che la maggior parte dei disturbi della fase luteinica si manifesta nella fase follicolare del ciclo. Livelli di progesterone costantemente ridotti nella seconda fase sono una conseguenza di una follicologenesi alterata nella prima fase del ciclo. Questo disturbo può essere corretto con maggiore successo somministrando basse dosi di clomifene citrato nella fase follicolare precoce rispetto alla prescrizione di progesterone nella seconda fase del ciclo.
Nel 1° ciclo, la dose di clomifene citrato è di 50 mg/die dal 5° al 9° giorno del ciclo mestruale. L'efficacia viene monitorata mediante grafici della temperatura rettale, misurazioni del livello di progesterone nella seconda fase del ciclo o ecografia dinamica. Se l'effetto non è sufficiente nel 2° ciclo di stimolazione dell'ovulazione, la dose di clomifene citrato deve essere aumentata a 100 mg/die dal 5° al 9° giorno del ciclo. La dose massima possibile nel 3° ciclo di stimolazione dell'ovulazione è di 150 mg/die. Tale aumento della dose è possibile solo se il farmaco è ben tollerato (assenza di dolore intenso al basso ventre e alla parte bassa della schiena e assenza di altri segni di iperstimolazione ovarica).
La seconda opzione terapeutica: la terapia sostitutiva con preparati a base di progesterone, che promuovono la completa trasformazione secretoria dell'endometrio, ottenendo l'effetto necessario nelle pazienti con aborto spontaneo abituale con ovulazione preservata. Inoltre, negli ultimi anni è stato dimostrato che la somministrazione di preparati a base di progesterone ha non solo un effetto ormonale, ma anche immunomodulatorio, sopprimendo le reazioni di rigetto da parte delle cellule immunocompetenti dell'endometrio. In particolare, un effetto simile è stato descritto per il diidrogesterone alla dose di 20 mg/die. Per la terapia sostitutiva, si utilizza il didrogesterone alla dose di 20 mg/die per via orale o il progesterone micronizzato per via vaginale alla dose di 200 mg/die. Il trattamento viene effettuato il 2° giorno dopo l'ovulazione (il giorno successivo all'aumento della temperatura rettale) e continuato per 10 giorni. In caso di gravidanza, il trattamento con preparati a base di progesterone deve essere continuato.
La ricerca moderna non ha confermato l'efficacia della gonadotropina corionica umana nel trattamento dell'aborto spontaneo ricorrente.
In caso di iperandrogenismo (genesi ovarica o surrenalica) in pazienti con aborto spontaneo abituale, il trattamento farmacologico è indicato a causa dell'effetto degli androgeni sulla completezza dell'ovulazione e sullo stato dell'endometrio. In caso di alterazione della biosintesi degli androgeni surrenalici, è possibile un loro effetto virilizzante sul feto femminile, pertanto la terapia steroidea viene eseguita nell'interesse del feto.
Iperandrogenismo di origine ovarica (ovaie policistiche)
Anamnesi, esame fisico e risultati degli esami speciali
- Anamnesi: menarca tardivo, disturbi del ciclo mestruale come l'oligomenorrea (solitamente primaria, meno spesso secondaria). Le gravidanze sono rare, di solito si interrompono spontaneamente nel primo trimestre, con lunghi periodi di infertilità tra le gravidanze.
- Esame: irsutismo, acne, smagliature, alto indice di massa corporea (facoltativo).
- Grafici della temperatura rettale: cicli anovulatori alternati a cicli con ovulazione e NLF.
- Esame ormonale: livelli elevati di testosterone, i livelli di FSH e LH possono essere elevati, il rapporto LH/FSH è superiore a 3. Ecografia: ovaie policistiche.
Trattamento
Trattamento non farmacologico
Perdita di peso: dietetica, attività fisica.
Trattamento farmacologico
- Orlistat alla dose di 120 mg con ogni pasto principale. La durata del trattamento viene determinata tenendo conto dell'effetto e della tollerabilità.
- Riduzione preliminare del testosterone con preparati contenenti ciproterone acetato (2 mg) ed EE (35 mcg) per 3 cicli mestruali.
- Sospensione del contraccettivo, supporto ormonale della seconda fase del ciclo (terapia gestagena) - didrogesterone alla dose di 20 mg/die dal 16° al 25° giorno del ciclo mestruale. In assenza di ovulazione spontanea, procedere alla fase successiva.
- Stimolazione dell'ovulazione con clomifene citrato alla dose iniziale di 50 mg/die dal 5° al 9° giorno del ciclo mestruale con terapia contemporanea con gestageni (didrogesterone alla dose di 20 mg/die dal 16° al 25° giorno del ciclo) e desametasone (0,5 mg).
- In assenza di gravidanza, la dose di clomifene citrato viene aumentata a 100-150 mg/die con la somministrazione di gestageni nella seconda fase del ciclo e desametasone (0,5 mg). È stato stabilito che, sebbene il desametasone riduca solo il livello di androgeni surrenalici, l'ovulazione e il concepimento si verificano significativamente più spesso con il trattamento con clomifene citrato e desametasone rispetto all'uso del solo clomifene citrato [12].
- Si effettuano tre cicli di stimolazione dell'ovulazione, dopo i quali si raccomanda una pausa di tre cicli mestruali con supporto gestazionale e si decide di intervenire chirurgicamente con accesso laparoscopico (resezione a cuneo delle ovaie, vaporizzazione laser).
Ulteriore gestione del paziente
La gestione della gravidanza deve essere accompagnata da supporto gestagenico fino a 16 settimane di gravidanza (didrogesterone alla dose di 20 mg/die o progesterone micronizzato alla dose di 200 mg/die); il desametasone è prescritto solo nel primo trimestre di gravidanza. Il monitoraggio è obbligatorio per la diagnosi tempestiva di insufficienza istmo-cervicale e, se necessario, la sua correzione chirurgica.
Iperandrogenismo surrenalico (sindrome adrenogenitale puberale e postpuberale)
La sindrome adrenogenitale (AGS) è una malattia ereditaria associata a un'alterazione della sintesi di ormoni nella corteccia surrenale dovuta a danni ai geni responsabili della sintesi di diversi sistemi enzimatici. La malattia è ereditaria con modalità autosomica recessiva, con la trasmissione di geni mutanti da entrambi i genitori, portatori sani.
Nel 90% dei casi, la sindrome adrenogenitale è causata da mutazioni nel gene CYP21B, che comportano un'interruzione nella sintesi della 21-idrossilasi.
Anamnesi, esame fisico e risultati degli esami speciali
- Anamnesi: menarca tardivo, ciclo mestruale leggermente prolungato, possibile oligomenorrea, aborti spontanei nel primo trimestre, possibile infertilità.
- Esame: acne, irsutismo, corporatura androide (spalle larghe, bacino stretto), ipertrofia clitoridea.
- Grafici della temperatura rettale: cicli anovulatori alternati a cicli con ovulazione e NLF.
- Test ormonale: livelli elevati di 17-OP, DHEAS.
- Ecografia: le ovaie non sono modificate.
Un segno patognomonico al di fuori della gravidanza è l'aumento della concentrazione di 17-OP nel plasma sanguigno.
Attualmente, per diagnosticare la forma latente e non classica di iperandrogenismo surrenalico si utilizza un test con ACTH. Per questo test viene utilizzato Synacthen, un polipeptide sintetico che possiede le proprietà dell'ACTH endogeno, ovvero stimola le fasi iniziali della sintesi degli ormoni steroidei a partire dal colesterolo nelle ghiandole surrenali.
Test con Synacthen (analogo dell'ACTH): 1 ml (0,5 mg) di Synacthen viene iniettato per via sottocutanea nella spalla. Il contenuto iniziale di 17-OP e cortisolo viene inizialmente determinato nel campione di plasma sanguigno prelevato al mattino dopo 9 ore. Un campione di sangue di controllo viene prelevato 9 ore dopo l'iniezione per determinare il livello di 17-OP e cortisolo. L'indice di determinazione (D) viene quindi calcolato utilizzando la formula:
D = 0,052 × 17-OP + 0,005 × Cortisolo/17-OP - 0,018 × Cortisolo/17-OP
Se il coefficiente D è inferiore o uguale a 0,069, ciò indica l'assenza di iperandrogenismo surrenalico. Se il coefficiente D è superiore a 0,069, si deve considerare che l'iperandrogenismo sia causato da una disfunzione delle ghiandole surrenali.
Trattamento farmacologico
Il cardine del trattamento dell'iperandrogenismo dovuto a deficit di 21-idrossilasi sono i glucocorticoidi, utilizzati per sopprimere l'eccessiva secrezione di androgeni.
Ulteriore gestione del paziente
A causa dell'effetto virilizzante degli androgeni materni sul feto, in caso di diagnosi accertata di iperandrogenismo surrenalico, il trattamento con desametasone a una dose iniziale di 0,25 mg viene prescritto prima della gravidanza e proseguito a una dose individualizzata (da 0,5 a 1 mg) per tutta la gravidanza. In una donna con aborti spontanei abituali e affetta da iperandrogenismo surrenalico, è inappropriato interrompere il trattamento, poiché la frequenza di aborti spontanei in assenza di trattamento raggiunge il 14%, mentre con la prosecuzione del trattamento scende al 9%.
Considerando che le pazienti con sindrome adrenogenitale possono trasmettere questo gene al feto, è necessario condurre una diagnosi prenatale: a 17-18 settimane di gravidanza, viene prescritto un esame del sangue per determinare il contenuto di 17-OP nella madre. Se il livello dell'ormone nel sangue è elevato, viene determinata la sua concentrazione nel liquido amniotico. Se il contenuto di 17-OP nel liquido amniotico è elevato, viene diagnosticata la sindrome adrenogenitale nel feto. Sfortunatamente, è impossibile determinare la gravità della sindrome adrenogenitale (forma lieve o grave con perdita di sali) in base al livello di 17-OP nel liquido amniotico. La decisione di mantenere la gravidanza in questa situazione spetta ai genitori.
Se il padre del bambino è portatore del gene della sindrome adrenogenitale e in famiglia sono stati riscontrati casi di bambini nati con questa sindrome, il paziente, anche in assenza di iperandrogenismo surrenalico, riceve desametasone nell'interesse del feto (per prevenire la virilizzazione del feto di sesso femminile) alla dose di 20 mcg/kg di peso corporeo, massimo 1,5 mg/die in 2-3 dosi dopo i pasti. A 17-18 settimane, dopo aver determinato il sesso del feto e l'espressione del gene della sindrome adrenogenitale (in base ai risultati dell'amniocentesi), il trattamento viene continuato fino al termine della gravidanza se il feto è una femmina con sindrome adrenogenitale. Se il feto è un maschio o una femmina non portatrice del gene della sindrome adrenogenitale, il desametasone può essere interrotto.
Se una donna con aborto spontaneo abituale soffre di iperandrogenismo surrenalico, il trattamento con desametasone viene continuato per tutta la gravidanza e interrotto solo dopo il parto. Il terzo giorno dopo il parto, la dose di desametasone viene gradualmente ridotta (di 0,125 mg ogni 3 giorni) fino alla completa interruzione nel periodo postpartum.
Iperandrogenismo di genesi mista (ovarica e surrenalica)
Anamnesi, esame fisico e risultati degli esami speciali
- Anamnesi: menarca tardivo, disturbi del ciclo mestruale come oligomenorrea (solitamente primaria, meno spesso secondaria), amenorrea, possibili traumi, commozioni cerebrali. Le gravidanze sono rare, di solito si interrompono spontaneamente nel primo trimestre, lunghi periodi di infertilità tra le gravidanze.
- Esame fisico: irsutismo, acne, smagliature, acanthosis nigricans, indice di massa corporea elevato, ipertensione.
- Grafici della temperatura rettale: cicli anovulatori alternati a cicli con ovulazione e NLF.
- Esame ormonale: livelli elevati di testosterone, livelli di FSH e LH possono essere elevati, rapporto LH/FSH maggiore di 3, livelli elevati di DHEAS, livelli di 17-OP, può essere presente iperprolattinemia.
- Ecografia: ovaie policistiche.
- Elettroencefalografia: cambiamenti nell'attività bioelettrica del cervello.
- Iperinsulinemia, disturbi del metabolismo lipidico (colesterolo alto, lipoproteine a bassa densità e lipoproteine a bassissima densità), ridotta tolleranza al glucosio o livelli elevati di glucosio nel sangue.
Trattamento
Trattamento non farmacologico
Perdita di peso (dieta ipocalorica, attività fisica).
Trattamento farmacologico
Prima fase - in presenza di insulino-resistenza, si consiglia di prescrivere metformina alla dose giornaliera di 1000-1500 mg per aumentare la sensibilità all'insulina.
Seconda fase: in caso di gravi disturbi del ciclo mestruale e alti livelli di testosterone, si consiglia di prescrivere farmaci con effetto antiandrogeno contenenti ciproterone acetato (2 mg) ed etinilestradiolo (35 mcg) per 3 mesi.
La terza fase è la stimolazione dell'ovulazione seguita dal supporto gestageno (lo schema è descritto sopra) e dall'assunzione di desametasone alla dose giornaliera di 0,25-0,5 mg.
In caso di iperprolattinemia e ipotiroidismo, è necessario eseguire un'adeguata correzione farmacologica durante i cicli di stimolazione dell'ovulazione. In caso di gravidanza, la bromocriptina deve essere interrotta e la levotiroxina deve essere continuata.
Se la stimolazione dell'ovulazione è inefficace, si deve valutare se prescrivere induttori diretti dell'ovulazione, l'opportunità di un trattamento chirurgico delle ovaie policistiche o la fecondazione in vitro.
Ulteriore gestione del paziente
Nelle pazienti con sindrome metabolica, la gravidanza è spesso complicata da ipertensione arteriosa, nefropatia e ipercoagulazione, per cui è necessario monitorare la pressione arteriosa, eseguire l'emostasi sin dalle prime fasi della gravidanza e correggere i disturbi insorti (se necessario) con farmaci antipertensivi, antiaggreganti piastrinici e anticoagulanti. I farmaci gestageni vengono prescritti fino alla 16a settimana di gravidanza: didrogesterone alla dose di 20 mg/die o progesterone micronizzato alla dose di 200 mg/die in 2 dosi.
Tutte le donne con iperandrogenismo rappresentano un gruppo a rischio per lo sviluppo di insufficienza istmo-cervicale. Il monitoraggio delle condizioni della cervice deve essere effettuato a partire dalla 16a settimana di gravidanza e, se necessario, si può ricorrere alla correzione chirurgica dell'insufficienza istmo-cervicale.
Cause immunologiche dell'aborto abituale
È noto che circa l'80% di tutti i casi di aborti ripetuti precedentemente inspiegati (escludendo cause genetiche, anatomiche e ormonali) è associato a disturbi immunitari. Si distinguono disturbi autoimmuni e alloimmuni, che portano ad aborti spontanei ricorrenti.
Nei processi autoimmuni, i tessuti del sistema immunitario diventano oggetto di aggressione, ovvero la risposta immunitaria è diretta contro i propri antigeni. In questa situazione, il feto soffre secondariamente a causa del danno ai tessuti materni.
Nelle malattie alloimmuni, la risposta immunitaria della donna è diretta contro antigeni embrionali/fetali ricevuti dal padre e che sono potenzialmente estranei all'organismo della madre.
Le malattie autoimmuni più frequentemente riscontrate nelle pazienti con aborto spontaneo abituale includono la presenza di autoanticorpi antifosfolipidi, antitiroidei e antinucleo nel siero. Pertanto, è stato stabilito che il 31% delle donne con aborto spontaneo abituale al di fuori della gravidanza presenta autoanticorpi contro la tireoglobulina e la perossidasi tiroidea (autoanticorpi microsomiali della tiroide [perossidasi tiroidea]); in questi casi, il rischio di aborto spontaneo nel primo trimestre di gravidanza aumenta al 20%. Nell'aborto spontaneo abituale, la presenza di anticorpi antinucleo e antitiroidei indica la necessità di ulteriori esami per identificare il processo autoimmune e confermare la diagnosi.
La sindrome da antifosfolipidi (APS) è tuttora una condizione autoimmune generalmente riconosciuta che porta alla morte dell'embrione/feto.
Disturbi alloimmuni
Attualmente, i processi alloimmuni che portano al rigetto fetale includono la presenza di un numero aumentato (più di 3) di antigeni comuni del sistema del complesso maggiore di istocompatibilità nei coniugi (spesso osservato nei matrimoni consanguinei); bassi livelli di fattori bloccanti nel siero della madre; livelli aumentati di cellule natural killer (cellule NK CD56, CD16) nell'endometrio e nel sangue periferico della madre sia al di fuori che durante la gravidanza; alti livelli di concentrazione di numerose citochine nell'endometrio e nel siero sanguigno, in particolare, γ-interferone, fattore di necrosi tumorale a, interleuchine-1 e 2.
Attualmente, sono in fase di studio i fattori alloimmuni che causano aborti precoci e i metodi per correggere tali condizioni. Non esiste un consenso unanime sui metodi terapeutici. Secondo alcuni ricercatori, l'immunizzazione attiva con linfociti di donatori non produce un effetto significativo, mentre altri autori descrivono un effetto positivo significativo con tale immunizzazione e il trattamento con immunoglobuline.
Attualmente, uno degli agenti immunomodulatori più efficaci nelle prime fasi della gravidanza è il progesterone. In particolare, studi hanno dimostrato il ruolo del didrogesterone alla dose giornaliera di 20 mg nelle donne con aborti spontanei ricorrenti nel primo trimestre di gravidanza, con un aumento del livello di cellule CD56 nell'endometrio.
 [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
[ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
Trombofilie geneticamente determinate
Le seguenti forme di trombofilia geneticamente determinate sono considerate condizioni trombofiliche durante la gravidanza che portano ad aborto spontaneo abituale.
- Deficit di antitrombina III.
- Mutazione del fattore V (mutazione di Leiden).
- Carenza di proteina C.
- Carenza di proteina S.
- Mutazione G20210A del gene della protrombina.
- Iperomocisteinemia.
L'esame per identificare cause rare di trombofilia è necessario nei casi in cui si sono verificate:
- anamnesi familiare - tromboembolia prima dei 40 anni nei parenti;
- episodi attendibili di trombosi venosa e/o arteriosa prima dei 40 anni di età;
- trombosi ricorrente nel paziente e nei parenti stretti;
- complicazioni tromboemboliche durante la gravidanza e dopo il parto quando si utilizzano contraccettivi ormonali;
- ripetute perdite di gravidanza, nati morti, ritardo della crescita intrauterina, distacco della placenta;
- preeclampsia ad esordio precoce, sindrome HELLP.
Cause infettive di aborto spontaneo abituale
Il ruolo del fattore infettivo come causa di aborto spontaneo abituale è attualmente ampiamente dibattuto. È noto che l'infezione primaria nelle prime fasi della gravidanza può causare danni all'embrione incompatibili con la vita, con conseguente aborto spontaneo sporadico. Tuttavia, la probabilità di riattivazione dell'infezione concomitante con ripetute perdite di gravidanza è trascurabile. Inoltre, al momento non sono stati identificati microrganismi che provocano aborto spontaneo abituale. Studi condotti negli ultimi anni hanno dimostrato che la maggior parte delle donne con aborto spontaneo abituale ed endometrite cronica presenta una prevalenza di 2-3 o più tipi di microrganismi e virus anaerobi obbligati nell'endometrio.
Secondo VM Sidelnikova et al., nelle donne affette da aborto spontaneo abituale, la diagnosi di endometrite cronica al di fuori della gravidanza è stata confermata istologicamente nel 73,1% dei casi e nell'86,7% è stata osservata la persistenza di microrganismi opportunisti nell'endometrio, che può certamente essere la causa dell'attivazione di processi immunopatologici. L'infezione virale mista persistente (virus herpes simplex, Coxsackie A, Coxsackie B, enterovirus 68-71, citomegalovirus) si riscontra nelle pazienti con aborto spontaneo abituale significativamente più spesso rispetto alle donne con una storia ostetrica normale. K. Kohut et al. (1997) hanno dimostrato che la percentuale di alterazioni infiammatorie nell'endometrio e nel tessuto deciduale nelle pazienti con aborto spontaneo primario ricorrente è significativamente più alta rispetto alle donne dopo aborto spontaneo con una storia di almeno un parto a termine.
La colonizzazione batterica e virale dell'endometrio deriva solitamente dall'incapacità del sistema immunitario e delle forze protettive aspecifiche dell'organismo (sistema del complemento, fagocitosi) di eliminare completamente l'agente infettivo e, allo stesso tempo, la sua diffusione è limitata dall'attivazione dei linfociti T (T-helper, cellule natural killer) e dei macrofagi. In tutti i casi sopra descritti, si verifica una persistenza di microrganismi, caratterizzata dall'attrazione di fagociti mononucleati, cellule natural killer, cellule T-helper, che sintetizzano varie citochine, verso il sito di infiammazione cronica. Apparentemente, tale stato dell'endometrio impedisce la creazione di un'immunosoppressione locale nel periodo preimpianto, necessaria per formare una barriera protettiva e prevenire il rigetto di un feto semi-estraneo.
A questo proposito, prima della gravidanza, alle donne con aborti spontanei abituali dovrebbe essere diagnosticata un'endometrite cronica. Per stabilire o escludere questa diagnosi, viene eseguita una biopsia endometriale tra il 7° e l'8° giorno del ciclo mestruale, con esame istologico, PCR ed esame batteriologico del materiale prelevato dalla cavità uterina. Una volta confermata la diagnosi, l'endometrite cronica viene trattata secondo gli standard per il trattamento delle malattie infiammatorie degli organi pelvici.

