Esperto medico dell'articolo
Nuove pubblicazioni
Glioma del cervello
Ultima recensione: 29.06.2025

Tutti i contenuti di iLive sono revisionati o verificati da un punto di vista medico per garantire la massima precisione possibile.
Abbiamo linee guida rigorose in materia di sourcing e colleghiamo solo a siti di media affidabili, istituti di ricerca accademici e, ove possibile, studi rivisti dal punto di vista medico. Nota che i numeri tra parentesi ([1], [2], ecc.) Sono link cliccabili per questi studi.
Se ritieni che uno qualsiasi dei nostri contenuti sia impreciso, scaduto o comunque discutibile, selezionalo e premi Ctrl + Invio.
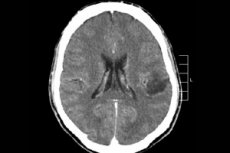
Tra i numerosi processi tumorali del sistema nervoso centrale, il glioma cerebrale è quello più frequentemente diagnosticato: questo termine è collettivo, la neoplasia combina tutti i focolai oligodendrogliali e astrocitari diffusi, astrocitoma, astroblastoma e così via. Tale tumore può avere un diverso grado di malignità ed è formato da strutture gliali, cellule localizzate attorno ai neuroni. Le principali aree di localizzazione dei gliomi sono gli emisferi cerebrali, le pareti dei ventricoli cerebrali e il chiasma, l'area di intersezione parziale delle fibre del nervo ottico. Esternamente, il tumore è un elemento nodulare di tonalità rosata o rossastra, di forma rotonda o fusiforme con confini indistinti. [ 1 ]
Epidemiologia
In circa il 5% dei casi, i gliomi sono associati a patologie ereditarie, in particolare neurofibromatosi e altre sindromi a trasmissione dominante. Gli esperti sottolineano che la maggior parte dei gliomi cerebrali si sviluppa in modo sporadico, ovvero senza una causa evidente.
Complessivamente, le neoplasie primarie del sistema nervoso centrale rappresentano circa il 2% di tutti i tumori, ovvero poco più di 21 casi ogni centomila abitanti. Tra questi, i gliomi si verificano nel 35-36% dei casi e oltre il 15% di essi sono glioblastomi.
Secondo alcuni dati, il glioma colpisce più spesso gli uomini che le donne: il tumore è particolarmente diffuso tra le persone di età superiore ai 50 anni.
L'incidenza globale dei gliomi tra gli anziani è aumentata significativamente negli ultimi decenni. Le ragioni di questo fenomeno non sono ancora state chiarite.
Secondo la definizione dell'Organizzazione Mondiale della Sanità, sono state identificate tre principali varianti di tumori gliali, che differiscono per le loro caratteristiche istologiche: oligodendrogliomi, astrocitomi e oligoastrocitomi combinati. L'incidenza di ciascun sottotipo di patologia a bassa malignità non è stata determinata in modo affidabile. Alcuni studi indicano un aumento dell'incidenza di oligodendrogliomi dal 5% al 30% e una diminuzione dell'incidenza di astrocitomi.
I tumori gliali sono in grado di infiltrarsi nel tessuto cerebrale e la stragrande maggioranza dei focolai di basso grado diventano maligni entro pochi anni. [ 2 ]
Le cause gliomi cerebrali
Il glioma cerebrale è un gruppo eterogeneo di processi tumorali, la cui caratteristica comune è la formazione a partire da strutture gliali del sistema nervoso centrale situate nel tessuto cerebrale. Questi tumori si dividono in due varianti istopatologiche: gliomi ad alto grado di malignità e gliomi a basso grado di malignità.
La fonte della crescita sono le cellule della neuroglia (astrociti, oligodendrociti), che forniscono la base strutturale e la vitalità dei neuroni cerebrali.
I processi tumorali gliali differiscono notevolmente in termini di struttura, alterazioni mutazionali nei geni, aggressività, caratteristiche cliniche, caratteristiche diagnostiche, risposta al trattamento e prognosi dei pazienti. Le neoplasie embrionali ed ependimali del sistema nervoso centrale – in particolare medulloblastomi ed ependimomi – differiscono nella loro struttura istologica, ma sono simili in termini di trattamento.
Gli elementi gliali furono classificati per la prima volta come categoria strutturale separata del sistema nervoso alla fine del XIX secolo.
Il tessuto neurogliale è costituito da cellule che svolgono funzioni ausiliarie: trofica, di supporto, protettiva e secretoria. Neuroni e gliociti coesistono tra loro, formano il sistema nervoso e sono di grande importanza nei processi generali dell'attività vitale dell'organismo.
I gliociti sono approssimativamente suddivisi in diverse forme principali: astrociti, oligodendrociti, cellule ependimali e microglia.
Ad oggi, gli scienziati non sono in grado di rispondere alla domanda sulle cause affidabili della formazione dei tumori neurogliali. Presumibilmente, un certo contributo negativo è dato dagli effetti radioattivi, dalle malattie infettive e dalle intossicazioni (soprattutto chimiche e professionali). Anche il fattore ereditario è importante.
I gliomi cerebrali derivano da neurogliociti anomali che presentano un difetto genetico che ne determina una crescita e una funzionalità anomale: tali strutture sono definite "immature". Le cellule incomplete si trovano più spesso in un'unica area, dove si forma il tumore.
In parole povere, la formazione gliale è il risultato della crescita caotica e sporadica di cellule neurogliali modificate. Il processo può svilupparsi a partire da ependimociti, oligodendrociti e astrociti (astrocitomi, inclusi quelli a cellule giganti e anaplastici). [ 3 ]
Fattori di rischio
Nonostante gli esperti non possano caratterizzare con precisione le cause della formazione di oncopatologie gliali, in alcuni casi è possibile prevenirne la comparsa eliminando i principali fattori di rischio:
- L'esposizione alle radiazioni ionizzanti ha un'attività cancerogena e può causare lo sviluppo di leucemia e la formazione di processi tumorali a struttura densa, anche in soggetti giovani. Anche procedure radiologiche mediche frequenti e non appropriate e radiazioni ultraviolette (incluso il solarium) rientrano tra i potenziali effetti cancerogeni e possono causare la comparsa di tumori in vari organi, incluso il cervello.
- Gli effetti avversi professionali e le intossicazioni hanno spesso un nesso causale con lo sviluppo di tumori. La produzione di gomma e vetro, pesticidi e combustibili, metalli e tessuti, vernici e reagenti di laboratorio è considerata particolarmente pericolosa. A rischio sono i lavoratori dell'industria aerospaziale, del carbone e dei metalli, degli impianti di produzione di prodotti chimici e derivati, dei materiali da costruzione e degli elettrodi, dei combustibili e dei lubrificanti, delle materie plastiche e dei monomeri.
- L'inquinamento di aria, acqua e suolo è responsabile fino al 4% di tutte le patologie tumorali nel mondo. Gli agenti cancerogeni, presenti in grandi quantità nell'ambiente, entrano nell'organismo attraverso l'aria inalata, l'acqua potabile e il cibo. Vivere in aree ecologicamente non sicure, come in prossimità di grandi impianti industriali e trafficati nodi di trasporto, è considerato particolarmente pericoloso.
- Anche le patologie infettive, in particolare le infezioni virali, possono creare condizioni favorevoli allo sviluppo di tumori. È importante tenerlo presente e vaccinarsi in anticipo, così come prevenire malattie infettive e parassitarie.
- L'intossicazione da tabacco e alcol sono considerati fattori di rischio per molte varietà di cancro, non solo per i gliomi cerebrali.
- Attività fisica insufficiente, sovrappeso, alimentazione scorretta, disturbi metabolici, traumi cranici, patologie vascolari sono ulteriori fattori di stress che possono provocare l'insorgenza di disturbi intracellulari.
- L'età avanzata è il periodo più comune per lo sviluppo di neoplasie nel corpo, pertanto chi ha più di 55 anni dovrebbe prendersi cura della propria salute in modo particolare.
Tuttavia, il principale e più significativo fattore di rischio per lo sviluppo del glioma resta la predisposizione ereditaria.
Patogenesi
Ad oggi, gli esperti hanno formulato diverse ipotesi sullo sviluppo dei gliomi cerebrali. Ogni teoria ha le sue basi, ma l'unico meccanismo patogenetico corretto e affidabile non è ancora stato identificato dagli scienziati. Nella maggior parte dei casi, si parla dei seguenti fattori nello sviluppo delle neoplasie:
Fallimento dell'embriogenesi, che consiste nell'interruzione della deposizione degli organi e nella formazione di strutture cellulari "sbagliate";
- Esposizione a raggi ionizzanti, potenziali cancerogeni sotto forma di agenti chimici, additivi alimentari, ecc.;
- Trauma cranico;
- Malattie genetiche trasmesse di generazione in generazione (glioma "familiare")
- Disfunzione immunitaria, neuroinfezioni.
La maggior parte dei gliomi presenta una crescita diffusa, con penetrazione nel tessuto cerebrale sano circostante. A seconda del grado di malignità, il tumore può svilupparsi per diversi anni senza alcuna manifestazione. In caso di decorso aggressivo, la sintomatologia peggiora rapidamente nell'arco di diversi mesi.
Parte della tumorigenesi è dovuta a cambiamenti disembriogenetici.
Il tronco encefalico può essere colpito a diversi livelli: il glioma diffuso del tronco encefalico, a sua volta, differirà sia anatomo-morfologicamente che clinicamente. Alcune di queste neoplasie, in particolare il glioma della placca tetraplegica, possono essere relativamente benigne, senza segni di progressione. Il glioma pontino, d'altra parte, è caratterizzato da una particolare malignità, aggressività e prognosi sfavorevole.
Lesioni diffuse delle strutture cerebrali, in cui più di tre zone anatomiche dei grandi emisferi sono coinvolte nel processo patologico, con possibile divergenza periventricolare e passaggio attraverso il corpo, chiamate gliomatosi. [ 4 ]
Il glioma cerebrale è ereditario?
Un rischio ben dimostrato di formazione di glioma cerebrale è ereditario, ovvero la presenza di tumori intracerebrali simili o di altro tipo in antenati diretti o nella stessa generazione. L'esposizione radioattiva e il contatto regolare o prolungato con potenziali agenti cancerogeni aggravano la situazione.
Non solo i gliomi possono essere ereditari, ma anche malattie che si accompagnano a un aumento della crescita tumorale indipendentemente dalla localizzazione – in particolare, possono essere la neurofibromatosi di tipo 1 e 2, la sindrome di Li-Fraumeni e la sindrome di Hippel-Lindau. Spesso nelle cellule di glioma vengono rilevate alterazioni di alcuni geni o cromosomi.
Le principali patologie che sono associate allo sviluppo del glioma nell'uomo sono riassunte nella tabella:
Patologia |
Cromosoma |
Gene |
Varietà di neoplasia |
Sindrome di Li-Fraumeni |
17р13 |
TR53 |
Neoplasie neuroectodermiche, astrocitoma. |
Neurofibromatosi |
17q11 |
NF1 |
Glioma del nervo ottico, astrocitoma pilocitico, neurofibromatosi |
Sindrome di Turcotte |
15:21, 19:22 |
HMLH1, HPSM2 |
Astrocitoma |
Sclerosi tuberosa (sindrome di Burneville). |
9q34, 16p13 |
TSC1, TSC2 |
Astrocitoma subependimale gigantocellulare |
Indipendentemente dalla natura del tumore gliale, che si tratti di un caso sporadico o di una patologia ereditaria, si tratta di un disturbo caratterizzato dall'espressione di un gene patologicamente alterato. A parte le neoplasie che si formano in seguito a effetti di apprendimento, in altre situazioni le cause delle alterazioni genetiche rimangono poco chiare.
Sintomi gliomi cerebrali
Le caratteristiche della sintomatologia focale dipendono direttamente dall'area di localizzazione del glioma cerebrale e sono conseguenza di vari tipi di disturbi endocrini, compressione del tessuto nervoso o processi distruttivi locali.
Se la neoplasia è localizzata nella zona parietale, nella persona prevalgono manifestazioni quali convulsioni, disturbi sensoriali, problemi di udito.
Quando il glioma è localizzato nella zona dell'emisfero dominante si riscontrano disturbi del linguaggio, agrafia e agnosia.
Le neoplasie del lobo temporale sono spesso accompagnate da crisi convulsive, afasia, compromissione dell'olfatto e della funzione visiva e dispnea.
Quando la pressione intracranica aumenta, si sviluppa un quadro corrispondente con restrizione del campo visivo, paralisi dei muscoli oculari ed emiplegia.
A causa della specificità del processo tumorale, il glioma cerebrale è sempre accompagnato da sintomi neurologici più o meno gravi. Inizialmente, si manifesta una notevole debolezza generale, il paziente ha un costante bisogno di dormire, la capacità lavorativa è compromessa e i processi cognitivi sono rallentati. È in questa fase che il rischio di una diagnosi errata e, di conseguenza, di prescrivere un trattamento errato è elevato. Tra le altre manifestazioni aspecifiche:
- Disturbi vestibolari, tra cui andatura instabile, perdita di equilibrio (ad esempio quando si va in bicicletta o si salgono le scale), intorpidimento degli arti, ecc.;
- Peggioramento graduale della vista, raddoppio dell'immagine visiva;
- Deterioramento della funzione uditiva;
- Discorso confuso;
- Nausea e vomito sotto forma di attacchi indipendenti da cibo o bevande;
- Indebolimento dei muscoli mimici e degli altri muscoli facciali;
- Disagio durante la deglutizione;
- Mal di testa ricorrenti (spesso nelle ore mattutine).
Il quadro clinico si espande e peggiora gradualmente: in alcuni pazienti avviene lentamente, in altri improvvisamente, letteralmente "davanti ai loro occhi", nel giro di poche settimane. In quest'ultimo caso, si tratta di un glioma cerebrale aggressivo, in rapida evoluzione.
Primi segni
Il glioma cerebrale nelle fasi iniziali dello sviluppo non presenta una sintomatologia marcata. Le prime manifestazioni sono spesso confuse con i segni di altre patologie meno gravi.
In generale, il quadro clinico del glioma è vario ed è determinato dalla sede e dalle dimensioni del focolaio patologico. Con la crescita della neoplasia, si sviluppano e aumentano i sintomi cerebrali generali:
- Mal di testa persistente e regolare che non risponde ai farmaci standard (farmaci antinfiammatori non steroidei);
- Nausea intermittente, a volte fino al vomito;
- Una sensazione fastidiosa e pesante nella zona del bulbo oculare;
- Convulsioni.
Le manifestazioni cerebrali sono particolarmente intense quando il tumore si sviluppa nei ventricoli o nel sistema liquorale. Il drenaggio del liquido cerebrospinale è compromesso, la pressione intracranica aumenta e si sviluppa idrocefalo. Il processo colpisce una determinata area del cervello, il che influenza lo sviluppo del quadro clinico corrispondente:
- Ci sono problemi con la funzione visiva;
- Disturbi del linguaggio;
- Si verificano disturbi vestibolari (vertigini, difficoltà nella coordinazione dei movimenti);
- Paresi, paralisi delle braccia, delle gambe;
- La memoria e la concentrazione sono compromesse;
- I processi di pensiero sono compromessi;
- Stanno emergendo disturbi comportamentali.
Nella fase iniziale, i sintomi sono praticamente assenti o sono così insignificanti da non attirare l'attenzione. È per questo motivo che gli esperti raccomandano vivamente esami preventivi e controlli regolari. Dopotutto, quanto prima viene rilevato il processo tumorale, tanto maggiori sono le possibilità di guarigione e sopravvivenza. [ 5 ]
Glioma cerebrale in un bambino
Tra i numerosi tumori cerebrali riscontrati in età infantile, la percentuale di gliomi varia dal 15 al 25%. I bambini possono contrarre la malattia nella prima adolescenza e nei primi vent'anni, sebbene sia molto raro che i bambini di età inferiore ai 3 anni ne siano colpiti.
La patologia ha origine da una mutazione delle cellule gliali. Ad oggi, non esiste una risposta al perché si verifichi questa mutazione.
L'unica cosa che è stata appresa in modo attendibile è che alcune malattie ereditarie associate a un rischio aumentato di crescita tumorale aumentano anche la probabilità di sviluppare un glioma cerebrale.
Inoltre, gli scienziati hanno scoperto che le cellule gliali possono presentare divergenze in singoli geni o cromosomi. A causa di questo disturbo, si innesca un meccanismo di mutazione, che non è ereditario. È possibile che ciò si verifichi in una delle fasi più precoci dello sviluppo.
È un fatto provato che la presenza di leucemia acuta o retinoblastoma nella storia del bambino, oppure l'irradiazione cerebrale per qualsiasi altro motivo, aumentano significativamente i rischi di formazione di glioma (dopo un certo periodo di tempo).
La sintomatologia infantile dipende dal grado di malignità e dalla localizzazione del focolaio patologico. Si distingue tra sintomi specifici e aspecifici:
- Sintomi aspecifici non sono "legati" all'area in cui è localizzato il glioma. Le manifestazioni comuni possono includere mal di testa, vertigini, scarso appetito, vomito non correlato all'assunzione di cibo, perdita di peso (per ragioni sconosciute), costante sensazione di affaticamento, calo del rendimento scolastico, difficoltà di concentrazione e disturbi comportamentali. Questi segni sono dovuti alla compressione delle strutture intracraniche, che può essere spiegata come una pressione diretta della massa in crescita, e a un disturbo della circolazione del liquido cerebrospinale. Esiste il rischio di idrocele cerebrale.
- La sintomatologia specifica dipende dalla localizzazione immediata del focolaio patologico gliale. Ad esempio, il tumore cerebellare è solitamente accompagnato da disturbi dell'andatura e dell'equilibrio nei bambini. La lesione del grande encefalo si manifesta con crisi convulsive e crescita tumorale nel midollo spinale, con paralisi della muscolatura. Può verificarsi un brusco peggioramento della vista del neonato, disturbi della coscienza, disturbi del sonno o altri problemi di sviluppo.
Di norma, durante l'infanzia, il glioma maligno si manifesta nel giro di poche settimane o mesi dal suo sviluppo: spesso è caratterizzato da una crescita rapida e incontrollata della neoplasia.
I bambini con tumori gliali maligni vengono curati da medici presso centri clinici pediatrici specializzati in oncologia pediatrica. Di norma, si utilizzano cicli di trattamento chirurgico, radioterapia e chemioterapia.
Il passo terapeutico più importante è la neurochirurgia. Più radicale è l'intervento, maggiori sono le possibilità di guarigione del bambino. Tuttavia, l'intervento chirurgico non è sempre possibile: in particolare, possono sorgere problemi con l'asportazione dei gliomi del tronco encefalico, così come con la radioterapia nei bambini di età inferiore ai 3 anni.
I gliomi del cervello centrale (intermedio e mesencefalo) sono difficili da rimuovere completamente, poiché sussiste il rischio di danneggiare i tessuti sani. Se la resezione completa del tumore è impossibile, al paziente viene prescritto un trattamento palliativo.
I bambini con gliomi maligni vengono trattati secondo protocolli standardizzati, definiti attraverso studi clinici rigorosamente controllati. I protocolli più comuni sono i seguenti:
- HIT HGG 2007: riguarda il trattamento di bambini di età compresa tra 3 e 17 anni.
- HIT SKK: adatto ai neonati (fino a tre anni di età) e non comporta trattamenti di radioterapia.
Le statistiche di sopravvivenza pediatrica per i gliomi non sono generalmente molto ottimistiche. Tuttavia, in nessun caso è possibile prevedere in anticipo l'efficacia delle misure terapeutiche per un determinato bambino. È importante seguire scrupolosamente tutte le prescrizioni del medico, il che aumenta significativamente le probabilità di guarigione.
Forme
I gliomi possono essere a bassa e alta malignità, con una crescita intensa e una propensione a metastatizzare. È importante comprendere che una bassa malignità non è sinonimo di sicurezza tumorale. Qualsiasi neoplasia cerebrale crea volume aggiuntivo, comprime le strutture cerebrali, causandone lo spostamento e l'aumento della pressione intracranica. Di conseguenza, il paziente può morire.
Esistono due tipi principali di astrocitomi maligni: i glioblastomi e gli astrocitomi anaplastici, suddivisi in base alle alterazioni molecolari. I tumori maligni secondari, che si sviluppano dagli astrocitomi e presentano un basso grado di malignità, si riscontrano più spesso nei pazienti giovani. I tumori gliali maligni iniziali si riscontrano più spesso nei pazienti anziani.
A seconda della posizione strutturale, i gliomi si distinguono in:
- Sopratentoriale (con localizzazione sopra il cervelletto nella zona dei ventricoli laterali, grandi emisferi);
- Sottotentoriale (con localizzazione sotto il cervelletto nella fossa cranica posteriore).
In base alle caratteristiche istologiche si distinguono i seguenti tipi di gliomi:
- Il glioma astrocitario è il più comune. A sua volta, si suddivide in nodulare e diffuso (quest'ultimo può essere caratterizzato da una rapida crescita e da un quadro clinico a ictus).
- Oligodendroglioma - si riscontra nel 5% dei pazienti. Presenta delle pietrificazioni, ovvero aree di calcificazione, più spesso nel lobo frontale.
- Glioma ependimale: si sviluppa dalle strutture che rivestono le pareti del canale centrale del midollo spinale e dei ventricoli. Spesso si sviluppa nello spessore della sostanza cerebrale e nel lume cerebrale.
Sono possibili anche focolai patologici misti come subependimoma, oligoastrocitoma, ecc.
Tutti i gliomi sono classificati nei seguenti stadi:
- Neoplasie relativamente benigne a crescita lenta, senza sintomi clinici evidenti.
- Gliomi "borderline" a crescita lenta che gradualmente si trasformano in stadio III e oltre.
- Malignant glioma.
- Glioma maligno con crescita e diffusione intense e aggressive, con prognosi sfavorevole.
Quanto più basso è lo stadio di malignità, tanto minore è la probabilità di metastasi e recidiva della neoplasia rimossa, e tanto maggiori sono le possibilità di guarigione del paziente. Il pericolo maggiore è rappresentato dal glioblastoma multiforme, un processo scarsamente differenziato con crescita e sviluppo intensi. [ 6 ]
Varianti possibili e più comuni del neuroglioma:
- Il glioma con lesioni del tronco encefalico e del ponte si localizza nell'area in cui l'encefalo si collega al midollo spinale. È lì che si localizzano importanti neurocentri responsabili delle funzioni respiratorie, cardiache e motorie. Se questa zona è danneggiata, il funzionamento dell'apparato vestibolare e fonatorio risulta compromesso. Viene spesso diagnosticato durante l'infanzia.
- Il glioma visivo colpisce le cellule neurogliali che circondano il nervo ottico. La patologia causa deficit visivo ed esoftalmo. Si sviluppa più frequentemente nei bambini.
- Il neuroglioma maligno basso è caratterizzato da una crescita lenta, localizzato più spesso nei grandi emisferi cerebrali e nel cervelletto. Si manifesta più frequentemente nei giovani (adolescenti e giovani adulti intorno ai 20 anni).
- Il glioma del corpo calloso è più caratteristico degli individui di età compresa tra 40 e 60 anni ed è rappresentato più comunemente dal glioblastoma.
- Il glioma del chiasma è localizzato nella zona della giunzione ottica, quindi è accompagnato da miopia, perdita del campo visivo, idrocefalo occlusivo e disturbi neuroendocrini. Può insorgere a qualsiasi età, ma colpisce più comunemente i pazienti con neurofibromatosi di tipo I.
Complicazioni e conseguenze
Gliomi a bassa malignità (grado I-II, altamente maligni, ad esempio astrocitoma, oligoastrocitoma, oligodendroglioma, xantoastrocitoma pleomorfo, ecc.) e ad alta malignità (grado III-IV, come glioblastoma, oligodendroglioma anaplastico, oligoastrocitoma e astrocitoma). I gliomi di grado IV sono particolarmente maligni.
Il glioma del tronco encefalico ha una prognosi molto sfavorevole proprio perché la neoplasia colpisce questa regione cerebrale, dove si concentrano le connessioni nervose più importanti tra il cervello e gli arti. Anche un tumore piuttosto piccolo in quest'area è sufficiente a far peggiorare rapidamente le condizioni del paziente e a provocare la paralisi.
Conseguenze non meno sfavorevoli si verificano quando vengono colpite altre regioni cerebrali. Spesso si tratta di un tumore della corteccia cerebrale, che pregiudica l'aspettativa di vita del paziente, nonostante il trattamento. Spesso è possibile solo posticipare la morte.
Secondo le statistiche mediche, il tasso di sopravvivenza a cinque anni è spesso solo del 10-20%. Sebbene queste cifre dipendano in larga misura sia dal grado di malignità che dall'esatta localizzazione e dal volume dell'intervento chirurgico eseguito. Dopo la completa rimozione del focolaio patologico, il tasso di sopravvivenza aumenta significativamente (a volte fino al 50%). La mancanza di trattamento o la sua impossibilità (per un motivo o per l'altro) porta sicuramente alla morte del paziente.
La maggior parte dei tumori gliali maligni di grado lieve è in grado di infiltrarsi nel tessuto cerebrale e di diventare maligna nel giro di diversi anni.
Il rischio di recidiva del glioma è considerato dagli esperti "altamente probabile". Tuttavia, il trattamento non deve essere trascurato: è importante garantire una buona qualità di vita il più a lungo possibile.
I gliomi recidivanti hanno sempre una prognosi peggiore rispetto ai tumori primari. Tuttavia, i moderni protocolli di trattamento basati su studi di ottimizzazione terapeutica spesso ottengono risultati sufficientemente buoni anche nei pazienti con neoplasie altamente maligne.
Possibili esiti dopo la chemioterapia:
- Emaciazione, deperimento, disturbi digestivi, malattie orali;
- Aumento dell'eccitabilità del sistema nervoso centrale, astenia;
- Deterioramento della funzione uditiva, tinnito e ronzio nelle orecchie;
- Convulsioni, disturbi depressivi;
- Crisi ipertensiva, alterazione del quadro ematico;
- Insufficienza renale;
- Processi allergici, perdita di capelli, comparsa di macchie pigmentate sul corpo.
Dopo la chemioterapia, i pazienti notano un marcato indebolimento del sistema immunitario, che può causare lo sviluppo di diverse patologie infettive.
Diagnostica gliomi cerebrali
Un glioma cerebrale può essere sospettato in base ai seguenti segni:
- Il paziente presenta crisi epilettiche localizzate o generalizzate, caratteristiche della localizzazione corticale della neoplasia e del suo lento sviluppo. Le crisi epilettiche si riscontrano nell'80% dei pazienti con tumori gliali di basso grado e nel 30% dei pazienti con gliomi di alto grado.
- L'aumento della pressione intracranica è particolarmente caratteristico delle masse localizzate nei lobi frontali e parietali destri. In associazione a un'elevata pressione intracranica, il disturbo della circolazione sanguigna e del liquor comporta la comparsa di cefalea costante e crescente, nausea con vomito, disturbi visivi e sonnolenza. Si osserva edema del nervo ottico e paralisi del nervo deviatore. Un aumento della pressione intracranica a valori critici può portare allo sviluppo di coma e morte. Un'altra causa di elevata pressione intracranica è l'idrocefalo.
- Il paziente presenta un quadro focale in crescita. Nelle formazioni sopratentoriali, le sfere motorie e sensoriali sono alterate, emiopia, afasia e disturbi cognitivi progrediscono.
Se il medico sospetta la presenza di una neoplasia cerebrale, è ottimale eseguire una risonanza magnetica (RM) senza o con l'aggiunta di mezzo di contrasto (gadolinio) per determinarne la sede, le dimensioni e altre caratteristiche. Se la risonanza magnetica non è possibile, si esegue una tomografia computerizzata e la spettroscopia a risonanza magnetica viene utilizzata come metodo di differenziazione. Nonostante l'efficacia di questi metodi diagnostici, la diagnosi definitiva viene formulata solo dopo la conferma istologica durante la resezione del focolaio tumorale.
Alla luce dei criteri sopra indicati, si raccomanda di iniziare la diagnosi con un'anamnesi accurata, la valutazione dello stato somato-neurologico e dello stato funzionale. Lo stato neurologico viene valutato insieme all'individuazione di probabili disturbi intellettivi e mnesici.
Esami di laboratorio consigliati:
- Un esame clinico del sangue generale completo;
- Un pannello completo di esami chimici del sangue;
- analisi delle urine;
- Studio della coagulazione del sangue;
- Analisi dei marcatori oncologici (AFP, beta-hCG, LDH - rilevante se si sospetta una lesione della zona pineale).
Per chiarire i punti prognostici nei pazienti con glioblastoma e astrocitoma anaplastico, vengono valutate la mutazione del gene IDH1|2-1 e la metilazione del gene MGMT. Nei pazienti con oligodendroglioma e oligoastrocitoma, viene determinata la codificazione di 1p|19q.
La diagnostica strumentale, innanzitutto, è rappresentata dalla risonanza magnetica obbligatoria dell'encefalo (talvolta anche del midollo spinale). La RM viene eseguita in tre proiezioni utilizzando le modalità standard T1-2, FLAIR e T1 con contrasto.
Quando indicato, vengono eseguite ecografie della rete vascolare, risonanza magnetica funzionale dei distretti motorio e vocale, nonché angiografia, spettroscopia, trattografia RM e perfusione.
Ulteriori indagini potrebbero includere:
- Elettroencefalografia del cervello;
- Consulti con un neurochirurgo, un oncologo, un radiologo, un oculista, un radiologo.
Diagnosi differenziale
La diagnosi differenziale va necessariamente effettuata con patologie non tumorali, in particolare con emorragie causate da malformazioni artero-venose o arteriose, nonché con processi demielinizzanti pseudotumorali, malattie infiammatorie (toxoplasmosi, ascesso cerebrale, ecc.).
Inoltre, distinguere il focolaio tumorale primario dalle metastasi del sistema nervoso centrale.
Grazie alle moderne capacità di risonanza magnetica, è possibile eseguire misure diagnostiche con sufficiente accuratezza, per individuare l'origine del focolaio primario nel sistema nervoso centrale. La RM cerebrale viene eseguita con o senza contrasto, in modalità FLAIR T1 e T2 (in tre proiezioni), oppure a fette sottili in proiezione assiale (modalità SPGR). Questi metodi diagnostici consentono di determinare con precisione la sede, le dimensioni, le caratteristiche strutturali della neoplasia, la sua relazione con la rete vascolare e le aree cerebrali adiacenti.
Inoltre, come parte della diagnosi differenziale, possono essere eseguite TC (con o senza contrasto), angio-TC (angio-RM), trattografia RM, perfusione RM o TC. Quando indicato, si utilizza TC/PET dell'encefalo con metionina, colina, tirosina e altri aminoacidi.
Trattamento gliomi cerebrali
La terapia specifica prevede interventi chirurgici, chemioterapici e radioterapici. È obbligatorio, se possibile, eseguire una resezione completa del focolaio tumorale, che consente un rapido sollievo dai sintomi e la conferma istologica della diagnosi.
L'irradiazione ha un effetto positivo sull'aumento dell'aspettativa di vita dei pazienti. Di norma, viene somministrata una dose totale di 58-60 Gy, suddivisa in dosi di irradiazione individuali di 1,8-2 Gy. Il tumore viene irradiato localmente, catturando fino a 3 cm di tessuto circostante. La radioterapia è più accettabile rispetto alla brachiterapia. In alcuni casi, sono raccomandati metodi radiochirurgici, che consistono nell'irradiazione con Gamma Knife o pedale del gas lineare, nonché nella terapia con boro a cattura di neutroni.
La necessità della chemioterapia adiuvante è controversa. In alcuni casi, i preparati a base di nitrosourea hanno permesso di aumentare l'aspettativa di vita dei pazienti fino a un anno e mezzo, ma alcuni risultati ottenuti con l'uso di tali chemiopreparati sono stati negativi. Oggi vengono utilizzati attivamente agenti citotossici, la terapia neoadiuvante (prima della radioterapia), i farmaci combinati, la chemioterapia intra-arteriosa o la chemioterapia ad alte dosi con ulteriore trapianto di cellule staminali.
In generale, per il successo del trattamento dei gliomi è molto importante un approccio globale, la cui entità dipende dalla posizione e dal grado di malignità della massa, dalle sue dimensioni e dalle condizioni di salute generale del paziente.
Per quanto riguarda il glioma del tronco encefalico, l'intervento chirurgico è raramente utilizzato. La principale controindicazione all'intervento è la localizzazione del focolaio, ovvero la vicinanza a organi vitali. In alcuni casi, è possibile rimuovere il glioma del tronco con metodi microchirurgici, con chemioterapia preoperatoria e postoperatoria. Tale intervento è molto complesso e richiede specifiche qualifiche da parte di un neurochirurgo.
La radiochirurgia, e in particolare la chirurgia stereotassica con esposizione ad alte dosi di radiazioni ionizzanti, è piuttosto efficace. L'utilizzo di tale tecnica nelle fasi precoci dello sviluppo della neoplasia consente talvolta di ottenere una remissione prolungata o addirittura la guarigione completa del paziente.
La radioterapia è spesso associata alla chemioterapia, il che ne migliora l'efficacia e ne riduce l'impatto. Nei gliomi, non tutti gli agenti chemiopreventivi hanno successo terapeutico, quindi vengono prescritti individualmente e le prescrizioni vengono modificate se necessario.
Per ridurre il dolore e abbassare la pressione intracranica, indipendentemente dal trattamento principale, viene prescritta una terapia sintomatica, in particolare farmaci corticosteroidi, analgesici, sedativi.
Farmaci
I farmaci corticosteroidi agiscono sul gonfiore e riducono la gravità dei sintomi neurologici per diversi giorni. Tuttavia, a causa dei molteplici effetti collaterali e della maggiore probabilità di interazioni avverse con i farmaci chemioterapici, vengono utilizzate dosi minime di steroidi, sospendendole il prima possibile (ad esempio, dopo un intervento chirurgico).
Gli anticonvulsivanti sono utilizzati sistematicamente come misura preventiva secondaria nei pazienti che hanno già avuto crisi epilettiche. Questi farmaci possono causare gravi sintomi avversi e interagire con i farmaci chemioterapici.
Gli anticoagulanti sono particolarmente rilevanti nella fase postoperatoria, poiché i rischi di formazione di tromboflebite nel glioma sono piuttosto elevati (fino al 25%).
Si prevede un buon effetto dall'assunzione di antidepressivi-ansiolitici. L'uso di metilfenidato 10-30 mg/die in due dosi spesso consente di ottimizzare le capacità cognitive, migliorare la qualità della vita e mantenere la capacità lavorativa.
L'insufficienza neurologica e i segni di edema cerebrale (dolore alla testa, disturbi della coscienza) vengono eliminati con farmaci corticosteroidi, in particolare con Prednisolone o Desametasone. |
Lo schema terapeutico e il dosaggio dei corticosteroidi vengono scelti individualmente, con l'obiettivo di raggiungere la dose minima efficace. Al termine del ciclo di trattamento, i farmaci vengono gradualmente sospesi. |
I corticosteroidi vengono assunti insieme a farmaci gastroprotettori: bloccanti della pompa protonica o bloccanti dell'istamina H2. |
I diuretici (furosemide, mannitolo) vengono prescritti in caso di gonfiore grave e spostamento delle strutture cerebrali, in aggiunta ai farmaci corticosteroidi. |
In caso di crisi convulsive (inclusa l'anamnesi) o sintomi epilettiformi all'elettroencefalogramma, viene prescritta anche una terapia anticonvulsivante. Gli anticonvulsivanti non sono prescritti a scopo profilattico. |
Ai pazienti con indicazione alla chemioterapia si raccomanda l'assunzione di anticonvulsivanti che non influiscano sulla funzionalità degli enzimi epatici. Farmaci di scelta: Lamotrigina, Acido Valproico, Levetiracetam. Non devono essere usati: Carbamazepina, Fenobarbital. |
Il mal di testa nei gliomi cerebrali viene gestito con un trattamento corticosteroideo. |
In alcuni casi di mal di testa possono essere utilizzati farmaci antinfiammatori non steroidei o tramadolo. |
Se il paziente sta assumendo farmaci antinfiammatori non steroidei, questi verranno sospesi alcuni giorni prima dell'intervento per ridurre al minimo il rischio di sanguinamento durante l'operazione. |
In casi selezionati di dolore, possono essere raccomandati analgesici narcotici, come il Fentanyl o la Trimeperidina. |
Per prevenire l'embolia polmonare a partire dal terzo giorno postoperatorio, viene prescritta la somministrazione di eparine a basso peso molecolare, in particolare Enoxaparina sodica o Nadroparina calcica. |
Se il paziente è in trattamento anticoagulante o antiaggregante sistematico, si passa alle eparine a basso peso molecolare al più tardi una settimana prima dell'intervento chirurgico, sospendendole ulteriormente il giorno prima dell'intervento e riprendendole 24-48 ore dopo. |
Se un paziente con glioma presenta trombosi venosa degli arti inferiori, si procede al trattamento con anticoagulanti diretti. Non si esclude la possibilità di posizionare un filtro CAVA. |
Chemioterapia per i gliomi maligni del cervello
I regimi chemioterapici antitumorali di base per i gliomi sono considerati:
- Lomustina 100 mg/m² il primo giorno, vincristina 1,5 mg/m² il primo e l'ottavo giorno, procarbazina 70 mg/m² dall'ottavo al ventunesimo giorno, cicli ogni sei settimane.
- Lomustina 110 mg/m² ogni sei settimane.
- Temozolomide 5/23 da 150 a 200 mg/m² dal primo al quinto giorno, ogni 28 giorni.
- Temozolomide come parte del trattamento chemioterapico-radiologico, 75 mg/m² al giorno in cui si somministra la radioterapia.
- Temozolomide con cisplatino o carboplatino (80 mg/m²) e temozolomide 150-200 mg/m² nei giorni da 1 a 5 ogni 4 settimane.
- Temozolomide 7/7 a 100 mg/m² nei giorni 1-8 e 15-22 del ciclo, con ripetizione ogni quattro settimane.
- Bevacizumab da 5 a 10 mg/kg nei giorni uno e quindicesimo e Irinotecan 200 mg/m² nei giorni uno e quindicesimo, ripetuti ogni quattro settimane.
- Bevacizumab da 5 a 10 mg/kg nei giorni uno, quindici e ventinove e Lomustina 90 mg/m² il primo giorno ogni sei settimane.
- Bevacizumab da 5 a 10 mg/kg nei giorni uno e quindicesimo, Lomustina 40 mg nei giorni uno, otto, quindici e ventidue, ripetuti ogni sei settimane.
- Bevacizumab da 5 a 10 mg/kg nei giorni uno e quindicesimo, ripetuto ogni quattro settimane.
I farmaci citostatici in molti casi inibiscono con successo la crescita delle cellule tumorali, ma non mostrano selettività verso tessuti e organi sani. Pertanto, gli esperti hanno identificato una serie di controindicazioni per le quali la chemioterapia del glioma è impossibile:
- Sensibilità individuale eccessiva agli agenti chemiopreventivi;
- Scompenso della funzionalità cardiaca, renale, epatica;
- Emopoiesi depressa nel midollo osseo;
- Problemi di funzionalità surrenale.
La chemioterapia viene somministrata con estrema cautela:
- Pazienti con significativi disturbi del ritmo cardiaco;
- Con il diabete;
- Per infezioni virali acute;
- Ai pazienti anziani;
- Pazienti affetti da alcolismo cronico (intossicazione cronica da alcol).
L'effetto collaterale più grave dei farmaci chemiopreventivi è la loro tossicità: i citostatici interferiscono selettivamente con la funzionalità delle cellule del sangue e ne alterano la composizione. Di conseguenza, la massa piastrinica ed eritrocitaria diminuisce e si sviluppa anemia.
Prima di prescrivere a un paziente un ciclo di chemioterapia, il medico valuta sempre il grado di tossicità dei farmaci e le possibili complicazioni successive al loro utilizzo. I cicli di chemioterapia sono sempre attentamente monitorati da specialisti e sottoposti a regolari esami del sangue.
Possibili conseguenze della terapia citostatica:
- Scarsità, emaciazione;
- Difficoltà a deglutire il cibo, secchezza delle mucose, parodontite, dispepsia;
- Instabilità del sistema nervoso centrale, disturbi maniaco-depressivi, sindrome convulsiva, astenia;
- Deterioramento della funzione uditiva;
- Aumento della pressione arteriosa fino allo sviluppo di crisi ipertensive;
- Diminuzione delle piastrine, dei globuli rossi, dei globuli bianchi, emorragie multiple, emorragie interne ed esterne;
- Insufficienza renale;
- Processi allergici;
- Perdita di capelli, comparsa di aree di aumentata pigmentazione.
Dopo cicli di chemioterapia, i pazienti corrono un rischio maggiore di sviluppare malattie infettive e sono comuni i dolori muscolari e articolari.
Per ridurre il rischio di effetti avversi post-chemioterapici, sono necessariamente prescritte ulteriori misure riabilitative, il cui scopo è ripristinare la normale conta ematica, stabilizzare l'attività cardiovascolare e normalizzare lo stato neurologico. È indispensabile un adeguato supporto psicologico.
Trattamento chirurgico
L'intervento chirurgico viene eseguito per rimuovere il più possibile il focolaio tumorale, il che a sua volta dovrebbe ridurre la pressione intracranica, attenuare l'insufficienza neurologica e fornire il biomateriale necessario per la ricerca.
- L'intervento chirurgico viene eseguito in un reparto o in una clinica neurochirurgica specializzata, i cui specialisti hanno esperienza in interventi neuro-oncologici.
- Il chirurgo esegue l'accesso mediante trapanazione ossea plastica nella zona in cui si sospetta la localizzazione del glioma.
- Se la neoplasia è localizzata anatomicamente in prossimità di aree o vie motorie, oppure nei nuclei o lungo i nervi cranici, si ricorre al monitoraggio neurofisiologico intraoperatorio.
- Sistemi di neuronavigazione, navigazione intraoperatoria mediante fluorescenza con acido 5-aminolevulenico sono auspicabili per massimizzare la rimozione della neoplasia.
- Dopo l'intervento, il giorno 1-2 viene eseguita una TC o una RM di controllo (con o senza iniezione di contrasto).
Se la resezione chirurgica del glioma è impossibile o viene inizialmente riconosciuta come inopportuna, oppure se si sospetta un linfoma del sistema nervoso centrale, viene eseguita una biopsia (aperta, stereotassica, con monitoraggio della navigazione, ecc.). |
I pazienti con gliomatosi cerebrale vengono esaminati mediante biopsia stereotassica, poiché la strategia terapeutica dipende in larga misura dal quadro istologico. |
In determinate situazioni (nei pazienti anziani, in caso di gravi disturbi neurologici, in caso di localizzazione del glioma nel tronco e in altre parti vitali) il trattamento viene pianificato in base ai sintomi e alle informazioni di imaging dopo una visita medica generale. |
Nei pazienti con astrocitoma piloide e forme nodulari di neoplasie del tronco encefalico e processi esofitici si raccomanda di sottoporsi a resezione o biopsia aperta. |
I pazienti con glioma pontino diffuso e altre neoplasie diffuse del tronco vengono trattati con radioterapia e terapia farmacologica antitumorale. In questi casi, la verifica non è necessaria. |
I pazienti con glioma a placche tetraplegico vengono sottoposti a risonanza magnetica sistematica e monitoraggio clinico dopo la rimozione dell'idrocele cerebrale. Se la neoplasia mostra segni di crescita, viene rimossa con ulteriore radioterapia. |
Quando si esegue una resezione parziale o una biopsia di un glioma maligno di basso grado, i pazienti con due o più fattori di rischio vengono necessariamente trattati con radioterapia e/o chemioterapia. |
La resezione totale è obbligatoria nei pazienti con astrocitoma subependimale a cellule giganti. |
L'everolimus è prescritto per l'astrocitoma subependimale diffuso a cellule giganti. |
Dopo l'intervento, l'astrocitoma piloide deve essere rimosso mediante risonanza magnetica per chiarire la qualità della resezione radicale del tessuto tumorale. |
Nel glioblastoma, la terapia postoperatoria deve essere combinata (radioterapia + chemioterapia) con la somministrazione di Temozolomide. |
Nell'astrocitoma anaplastico dopo l'intervento chirurgico, è indicata la radioterapia con ulteriore terapia farmacologica. Si utilizzano lomustina e temozolomide. |
I pazienti con oligodendroglioma anaplastico o oligoastrocitoma vengono sottoposti sia a radioterapia che a chemioterapia (monoterapia con temozolomide o PCV) dopo l'intervento chirurgico. |
I pazienti anziani con glioma maligno esteso e alto vengono irradiati in modalità ipofrazionata oppure viene eseguita una monoterapia con Temozolomide. |
In caso di recidiva di glioma, la possibilità di un reintervento e le successive strategie terapeutiche vengono discusse da un comitato di specialisti. Il regime ottimale per le recidive è: reintervento + chemioterapia sistemica + ripetuta esposizione alle radiazioni + misure palliative. In presenza di aree localizzate di recidiva tumorale, si può ricorrere alla radiochirurgia. |
I farmaci di scelta per la crescita ricorrente del glioma sono Temozolomide e Bevacizumab. |
La recidiva di oligodendrogliomi altamente maligni e di astrocitomi anaplastici è un'indicazione al trattamento con Temozolomide. |
Lo xantoastrocitoma pleomorfo viene rimosso senza chemioterapia adiuvante obbligatoria. |
Una delle peculiarità dei gliomi è la difficoltà nel trattamento e nella rimozione. Il chirurgo mira a rimuovere i tessuti della neoplasia il più completamente possibile, per ottenere una compensazione della condizione. Molti pazienti riescono a migliorare la qualità della vita e a prolungarla, ma per i tumori altamente maligni la prognosi rimane sfavorevole: vi è una maggiore probabilità di ricrescita del focolaio patologico.
Nutrizione per il glioma cerebrale
La dieta per i pazienti con tumori maligni è un punto importante, a cui purtroppo molti non prestano molta attenzione. Nel frattempo, grazie a cambiamenti nella dieta, è possibile rallentare lo sviluppo del glioma e rafforzare e indebolire il sistema immunitario.
Principali aree di cambiamento dietetico:
- Normalizzazione dei processi metabolici, rafforzamento della protezione immunitaria;
- Disintossicazione del corpo;
- Ottimizzazione del potenziale energetico;
- Garantire il normale funzionamento di tutti gli organi e sistemi del corpo durante un periodo così difficile per loro.
Una dieta razionale ed equilibrata è necessaria per i pazienti con neoplasie maligne in fase iniziale e per i pazienti con glioblastoma in fase avanzata. Una dieta accuratamente selezionata contribuisce al miglioramento del benessere generale e al recupero dei tessuti danneggiati, il che è particolarmente importante in vista di trattamenti con citostatici e radiazioni. L'equilibrio dei componenti nutrizionali e il corretto funzionamento dei processi metabolici prevengono la formazione di focolai infettivi, bloccano le reazioni infiammatorie e prevengono l'esaurimento dell'organismo.
Per il glioma cerebrale sono consigliati i seguenti alimenti e bevande:
- Frutta e verdura di colore rosso, giallo e arancione (pomodori, pesche, albicocche, carote, barbabietole, agrumi) contenenti carotenoidi, che proteggono le cellule sane dagli effetti negativi della radioterapia;
- Cavolo (cavolfiore, broccoli, cavoletti di Bruxelles), ravanello, senape e altri prodotti vegetali che contengono indolo, una sostanza attiva che neutralizza i fattori tossici e chimici avversi;
- Verdure a foglia verde (aneto, prezzemolo, giovani foglie di tarassaco e ortica, rabarbaro, rucola, spinaci), piselli e asparagi, fagioli asparagi e alghe (alghe marine, spirulina, clorella);
- Tè verde;
- Aglio, cipolla, ananas, che hanno capacità antitumorali e disintossicanti;
- Crusca, cereali, pane integrale, germogli di legumi, cereali e semi;
- Uva scura, lamponi, fragole e fragole, mirtilli, more, melograno, ribes, ribes nero, sorbo, mirtilli, olivello spinoso, ciliegie e altre bacche che contengono antiossidanti naturali che riducono gli effetti negativi dei radicali liberi, dei virus e degli agenti cancerogeni;
- Latticini a basso contenuto di grassi.
Non bisogna appesantire l'apparato digerente e tutto il corpo con cibi pesanti e grassi. È utile utilizzare succhi freschi, frullati e snack fatti in casa. È consigliabile aggiungere ai piatti fonti di acidi grassi omega-3, come olio di pesce, olio di semi di lino o semi di lino.
È meglio evitare completamente zucchero e dolci. Ma un cucchiaio di miele in una tazza d'acqua non farà male: i prodotti delle api hanno un pronunciato effetto antinfiammatorio, antiossidante e antitumorale. L'unica controindicazione all'uso del miele è un'allergia al prodotto.
Dalla dieta vanno esclusi:
- Carne, strutto, frattaglie;
- Burro, latticini grassi;
- Carne affumicata, salsicce, carne e pesce in scatola;
- Alcol in qualsiasi forma;
- Dolci, pasticcini, torte e pasticcini, caramelle e cioccolatini;
- Cibi pronti, fast food, snack;
- Cibi fritti.
Dovresti consumare quotidianamente una quantità sufficiente di verdura, frutta, verdura fresca e acqua potabile.
Durante la chemioterapia e per un certo periodo dopo, è consigliabile bere succhi di frutta e verdura fatti in casa, mangiare ricotta, latte e formaggio magri fatti in casa. È importante bere molti liquidi, lavarsi i denti e sciacquare la bocca spesso (circa 4 volte al giorno).
Pasti ottimali per i pazienti affetti da glioma cerebrale:
- Casseruole di verdure;
- Contorni e zuppe a base di cereali (preferibilmente grano saraceno, avena, riso, couscous, bulgur);
- Cheesecake al vapore, budini, sformati;
- Verdure stufate e al forno;
- Minestre, zuppe di verdure, primi e secondi piatti a base di legumi (anche di soia), paté e soufflé;
- Frullati, tè verde, composte e stuzzichini.
Prevenzione
Se una persona conduce uno stile di vita sano e tra i suoi familiari non sono stati riscontrati casi di patologia tumorale, ha tutte le probabilità di non contrarre il glioma cerebrale. Non esiste una prevenzione specifica per questi tumori, quindi i principali punti di prevenzione sono considerati una corretta alimentazione, l'attività fisica, l'astensione da cattive abitudini e l'assenza di rischi professionali e domestici.
Gli specialisti forniscono una serie di raccomandazioni semplici ma efficaci:
- Bevi più acqua pura, evita le bibite zuccherate, i succhi confezionati, le bevande energetiche e l'alcol.
- Evita i rischi professionali e domestici: minor contatto con sostanze chimiche, soluzioni corrosive e liquidi.
- Cercate di preparare il cibo bollindolo, stufandolo, cuocendolo al forno, ma non friggendolo. Preferite cibi sani e di qualità, fatti in casa.
- Una gran parte della tua dieta dovrebbe essere costituita da alimenti di origine vegetale, comprese le verdure a foglia verde, indipendentemente dal periodo dell'anno.
- Un altro fattore negativo è il sovrappeso, da cui è necessario liberarsi. Il controllo del peso è fondamentale per la salute di tutto l'organismo.
- Gli oli vegetali andrebbero sempre preferiti al burro e allo strutto.
- Se possibile, è auspicabile dare la preferenza a prodotti ecocompatibili, carne senza ormoni, verdura e frutta senza nitrati e pesticidi. È meglio evitare del tutto la carne rossa.
- Non assumere preparati multivitaminici senza indicazioni e in grandi quantità. Non assumere farmaci senza prescrizione medica: l'automedicazione è spesso molto, molto pericolosa.
- Se compaiono sintomi sospetti, è necessario consultare un medico, senza aspettare che la situazione peggiori, si sviluppino effetti avversi e complicazioni.
- I dolci e gli alimenti con un alto indice glicemico sono una componente indesiderabile della dieta.
- Prima una persona si rivolge al medico, maggiori sono le sue possibilità di guarigione (e questo vale per quasi tutte le malattie, compreso il glioma cerebrale).
Per prevenire la formazione di oncopatologie, è necessario dormire e riposare a sufficienza, evitare il consumo eccessivo di bevande alcoliche, dare la preferenza a cibi naturali di alta qualità, ridurre l'uso di gadget elettronici (in particolare, telefoni cellulari).
Le malattie tumorali colpiscono spesso le persone anziane. Pertanto, è importante monitorare la propria salute fin dalla giovane età e non innescare processi patologici con stili di vita e abitudini malsane.
Le cause profonde dell'oncologia non sono ancora state chiarite. Tuttavia, un certo ruolo giocano certamente condizioni lavorative e ambientali sfavorevoli, l'esposizione a radiazioni ionizzanti ed elettromagnetiche e i cambiamenti ormonali. Evitare di esporsi al sole a lungo e regolarmente, tollerare bruschi sbalzi di temperatura, surriscaldarsi in bagno o in sauna, fare spesso bagni o docce calde.
Un'altra domanda: come prevenire la recidiva del glioma cerebrale dopo un trattamento efficace? La recidiva della neoplasia è una complicanza complessa e, purtroppo, frequente, difficile da prevedere in anticipo. Ai pazienti può essere raccomandato di sottoporsi a visite e controlli preventivi regolari, di visitare un oncologo e un medico curante almeno due volte all'anno, di condurre uno stile di vita sano, di seguire un'alimentazione sana e naturale e di praticare un'attività fisica moderata. Un altro requisito è l'amore per la vita, un sano ottimismo e un atteggiamento positivo verso il successo in ogni circostanza. Questo include anche un clima amichevole in famiglia e al lavoro, pazienza e il supporto incondizionato delle persone vicine.
Previsione
Le condizioni del cervello e le caratteristiche del glioma al momento della diagnosi influenzano il tasso di sopravvivenza tanto quanto il trattamento somministrato. Una salute generale soddisfacente del paziente e la sua età migliorano la prognosi (la prognosi è più ottimistica nei pazienti giovani). Un indicatore importante è il quadro istologico della neoplasia. Pertanto, i gliomi di basso grado hanno una prognosi migliore rispetto ai gliomi anaplastici e, ancor di più, ai glioblastomi (i processi tumorali più sfavorevoli). Gli astrocitomi hanno una prognosi peggiore rispetto agli oligodendrogliomi.
Gli astrocitomi maligni rispondono scarsamente alla terapia e hanno un tasso di sopravvivenza relativamente basso, di sei-cinque anni. Allo stesso tempo, l'aspettativa di vita nei gliomi di basso grado è stimata tra 1 e 10 anni.
Gli astrocitomi maligni sono essenzialmente incurabili. L'orientamento del trattamento di solito prevede la riduzione delle manifestazioni neurologiche (inclusa la disfunzione cognitiva) e l'aumento dell'aspettativa di vita, mantenendo al contempo la migliore qualità di vita possibile. La terapia sintomatica è associata a misure riabilitative. Anche il lavoro di uno psicologo è importante.
Nell'ultimo decennio, gli scienziati hanno compiuto progressi nella comprensione della natura dei tumori cerebrali e delle modalità di trattamento. C'è ancora molto da fare per ottimizzare la prognosi della malattia. Il compito principale degli specialisti oggi è questo: il glioma cerebrale dovrebbe essere affrontato con diversi approcci per eliminare il problema in modo efficace e immediato, sia nelle fasi iniziali che in quelle successive dello sviluppo.

