Esperto medico dell'articolo
Nuove pubblicazioni
Ovaio
Ultima recensione: 04.07.2025

Tutti i contenuti di iLive sono revisionati o verificati da un punto di vista medico per garantire la massima precisione possibile.
Abbiamo linee guida rigorose in materia di sourcing e colleghiamo solo a siti di media affidabili, istituti di ricerca accademici e, ove possibile, studi rivisti dal punto di vista medico. Nota che i numeri tra parentesi ([1], [2], ecc.) Sono link cliccabili per questi studi.
Se ritieni che uno qualsiasi dei nostri contenuti sia impreciso, scaduto o comunque discutibile, selezionalo e premi Ctrl + Invio.
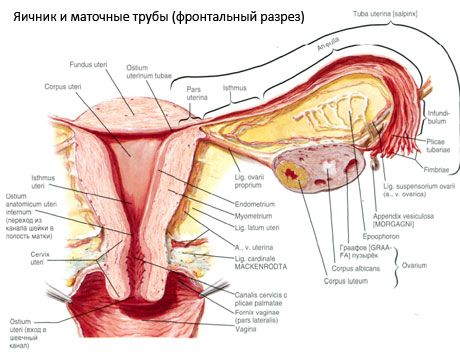
L'ovaio (ovarium; in greco ooforo) è un organo pari, una ghiandola riproduttiva femminile, situata nella cavità pelvica dietro il legamento largo dell'utero. Nelle ovaie si sviluppano e maturano le cellule riproduttive femminili (ovuli) e si formano gli ormoni sessuali femminili che entrano nel sangue e nella linfa. L'ovaio ha una forma ovoidale, leggermente appiattita in direzione anteroposteriore. Il colore dell'ovaio è rosato. Sulla superficie dell'ovaio di una donna che ha partorito sono visibili depressioni e cicatrici, tracce dell'ovulazione e della trasformazione dei corpi lutei. L'ovaio pesa 5-8 g. Le dimensioni dell'ovaio sono: lunghezza 2,5-5,5 cm, larghezza 1,5-3,0 cm, spessore fino a 2 cm. L'ovaio presenta due superfici libere: la superficie mediale (facies medialis), rivolta verso la cavità pelvica e parzialmente coperta dalla tuba di Falloppio, e la superficie laterale (facies lateralis), adiacente alla parete laterale della pelvi, fino a una depressione leggermente accentuata, la fossa ovarica. Questa fossa si trova nell'angolo tra i vasi iliaci esterni, ricoperti di peritoneo in alto, e le arterie uterine e otturatorie in basso. Dietro l'ovaio, l'uretere del lato corrispondente decorre retroperitonealmente dall'alto verso il basso.
Le superfici dell'ovaio si aprono in un margine libero (posteriore) convesso (margo liber), e anteriormente nel margine mesenterico (margo mesovaricus), attaccato tramite una breve piega del peritoneo (mesentere dell'ovaio) al foglietto posteriore del legamento largo dell'utero. Su questo margine anteriore dell'organo si trova una depressione scanalata, l'ilo dell'ovaio (hilum ovarii), attraverso la quale entrano nell'ovaio arterie e nervi, e fuoriescono vene e vasi linfatici. L'ovaio ha anche due estremità: l'estremità tubulare superiore arrotondata (extremitas tubaria), rivolta verso la tuba di Falloppio, e l'estremità uterina inferiore (extremitas utenna), collegata all'utero tramite il legamento ovarico (lig. ovarii proprium). Questo legamento, a forma di cordone rotondo di circa 6 mm di spessore, si estende dall'estremità uterina dell'ovaio all'angolo laterale dell'utero, situato tra i due lembi del legamento largo dell'utero. L'apparato legamentoso dell'ovaio comprende anche il legamento sospensore dell'ovaio (lig.suspensorium ovarii), una piega del peritoneo che si estende dalla parete della piccola pelvi fino all'ovaio e contiene al suo interno i vasi ovarici e fasci di fibre fibrose. L'ovaio è fissato da un breve mesentere (mesovario), una duplicazione del peritoneo che si estende dal lembo posteriore del legamento largo dell'utero fino al margine mesenterico dell'ovaio. Le ovaie stesse non sono rivestite dal peritoneo. La frangia ovarica più grande della tuba di Falloppio si inserisce all'estremità tubulare dell'ovaio. La topografia dell'ovaio dipende dalla posizione dell'utero e dalle sue dimensioni (durante la gravidanza). Le ovaie sono organi molto mobili della piccola cavità pelvica.
Vasi e nervi dell'ovaio
L'apporto di sangue alle ovaie è fornito dalle arterie ovariche aortiche...
I rami dell'arteria ovarica si anastomizzano ampiamente con i rami ovarici dell'arteria uterina. Il deflusso venoso dalle ovaie avviene principalmente nel plesso venoso ovarico, situato nella regione dell'ilo ovarico. Da qui, il deflusso del sangue avviene in due direzioni: attraverso le vene uterine e ovariche. La vena ovarica destra è valvolata e sfocia nella vena cava inferiore. La vena ovarica sinistra sfocia nella vena renale sinistra, sebbene non abbia valvole.
Il drenaggio linfatico dalle ovaie avviene attraverso i vasi linfatici, in particolare in abbondanza nella zona dell'organo di accesso, dove si distingue il plesso linfatico subovarico. Successivamente, la linfa viene scaricata lungo i vasi linfatici ovarici fino ai linfonodi paraaortici.
Innervazione delle ovaie
Simpatico: fornito dalle fibre postganglionari provenienti dal plesso celiaco (solare), mesenterico superiore e ipogastrico; parasimpatico: dai nervi sacrali viscerali.
Struttura dell'ovaio
La superficie dell'ovaio è ricoperta da un epitelio germinativo monostratificato. Al di sotto di esso si trova un denso rivestimento proteico di tessuto connettivo (tunica albuginea). Il tessuto connettivo dell'ovaio forma il suo stroma (stroma ovarii), ricco di fibre elastiche. La sostanza dell'ovaio, il suo parenchima, è suddivisa in strati esterni e interni. Lo strato interno, situato al centro dell'ovaio, più vicino alla sua porta, è chiamato midollo (medulla ovarii). In questo strato, in tessuto connettivo lasso, si trovano numerosi vasi sanguigni, linfatici e nervi. Lo strato esterno dell'ovaio, la corteccia (cortex ovarii), è più denso. Contiene molto tessuto connettivo, nel quale si trovano i follicoli ovarici primari in maturazione (folliculi ovarici primarii), i follicoli secondari (vescicolari) (folliculi ovarici secundarii, s.vesiculosi), nonché i follicoli maturi, i follicoli di Graaf (folliculi ovarici maturis), nonché i corpi gialli e atresici.
Ogni follicolo contiene un ovulo riproduttivo femminile, o ovocita (ovocito). L'ovulo ha un diametro fino a 150 µm, è rotondo e contiene un nucleo, una grande quantità di citoplasma che, oltre agli organelli cellulari, contiene inclusioni proteico-lipidiche (tuorlo) e glicogeno, necessari per il nutrimento dell'ovulo. L'ovulo solitamente esaurisce la sua riserva di nutrienti entro 12-24 ore dall'ovulazione. Se la fecondazione non avviene, l'ovulo muore.
L'ovulo umano è ricoperto da due membrane. All'interno si trova il citolemma, la membrana citoplasmatica dell'ovulo. All'esterno del citolemma si trova uno strato di cosiddette cellule follicolari, che proteggono l'ovulo e svolgono una funzione ormonale: secernono estrogeni.
La posizione fisiologica dell'utero, delle tube e delle ovaie è assicurata dagli apparati di sospensione, fissaggio e sostegno che uniscono il peritoneo, i legamenti e il tessuto pelvico. L'apparato di sospensione è rappresentato da formazioni pari e comprende i legamenti rotondi e larghi dell'utero, i legamenti propri e i legamenti sospensori delle ovaie. I legamenti larghi dell'utero, i legamenti propri e i legamenti sospensori delle ovaie mantengono l'utero in posizione mediana. I legamenti rotondi tirano in avanti il fondo dell'utero e ne garantiscono l'inclinazione fisiologica.
L'apparato di fissaggio (ancoraggio) assicura la posizione dell'utero al centro della piccola pelvi e ne rende praticamente impossibile lo spostamento laterale, avanti e indietro. Tuttavia, poiché l'apparato legamentoso si diparte dall'utero nella sua parte inferiore, sono possibili inclinazioni dell'utero in varie direzioni. L'apparato di fissaggio comprende legamenti situati nel tessuto lasso della pelvi e che si estendono dalla parte inferiore dell'utero alle pareti laterali, anteriori e posteriori della pelvi: legamenti sacro-magici, cardinali, uterovescicali e vescico-pubici.
Oltre al mesovario, si distinguono i seguenti legamenti ovarici:
- il legamento sospensore dell'ovaio, precedentemente denominato legamento infundibulopelvico. Si tratta di una piega del peritoneo attraversata da vasi sanguigni (a. e v. ovarica), vasi linfatici e nervi ovarici, tesa tra la parete laterale della pelvi, la fascia lombare (nella zona di divisione dell'arteria iliaca comune in esterna e interna) e l'estremità superiore (tubarica) dell'ovaio;
- Il legamento proprio dell'ovaio passa tra le foglie del legamento largo uterino, più vicino alla foglia posteriore, e collega l'estremità inferiore dell'ovaio con il margine laterale dell'utero. Il legamento proprio dell'ovaio si inserisce sull'utero tra l'inizio della tuba di Falloppio e il legamento rotondo, posteriormente e superiormente a quest'ultimo. Nello spessore del legamento passano i rami terminali dell'arteria uterina;
- Legamento appendicolare-ovarico Il legamento si estende dal mesentere dell'appendice all'ovaio destro o al legamento largo dell'utero sotto forma di una piega del peritoneo. Il legamento è incostante e si osserva in 1/2 - 1/3 delle donne.
L'apparato di sostegno è rappresentato dai muscoli e dalla fascia del pavimento pelvico, suddivisi in strati inferiore, medio e superiore (interno).
Il più potente è lo strato muscolare superiore (interno), rappresentato dal muscolo pari che solleva l'ano. È costituito da fasci muscolari che si diramano dal coccige alle ossa pelviche in tre direzioni (pubococcigeo, iliococcigeo e ischiococcigeo). Questo strato muscolare è anche chiamato diaframma pelvico.
Lo strato muscolare intermedio si trova tra la sinfisi, l'osso pubico e l'osso ischiatico. Lo strato muscolare intermedio, il diaframma urogenitale, occupa la metà anteriore dello sbocco pelvico, attraverso il quale passano l'uretra e la vagina. Nella sezione anteriore, tra i suoi foglietti, si trovano fasci muscolari che formano lo sfintere esterno dell'uretra, mentre nella sezione posteriore si trovano fasci muscolari che si estendono in direzione trasversale, il muscolo trasverso profondo del perineo.
Lo strato inferiore (esterno) dei muscoli del pavimento pelvico è costituito da muscoli superficiali, la cui forma ricorda il numero 8. Tra questi rientrano il muscolo bulbocavernoso, l'ischiocavernoso, lo sfintere anale esterno e il muscolo perineale trasverso superficiale.
Ontogenesi delle ovaie
Il processo di crescita e atresia dei follicoli inizia alla 20a settimana di gravidanza e, al momento del parto, nelle ovaie della bambina rimangono fino a 2 milioni di ovociti. Con il menarca, il loro numero diminuisce a 300.000. Durante l'intero periodo riproduttivo, non più di 500 follicoli raggiungono la maturità e ovulano. La crescita iniziale dei follicoli non dipende dalla stimolazione dell'FSH, è limitata e l'atresia si verifica rapidamente. Si ritiene che, al posto degli ormoni steroidei, i peptidi autocrini/paracrini locali siano il principale regolatore della crescita e dell'atresia dei follicoli primari. Si ritiene che il processo di crescita e atresia dei follicoli non sia interrotto da alcun processo fisiologico. Questo processo continua a tutte le età, incluso il periodo intrauterino e la menopausa, ed è interrotto da gravidanza, ovulazione e anovulazione. Il meccanismo che innesca la crescita dei follicoli e il loro numero in ogni specifico ciclo non è ancora chiaro.
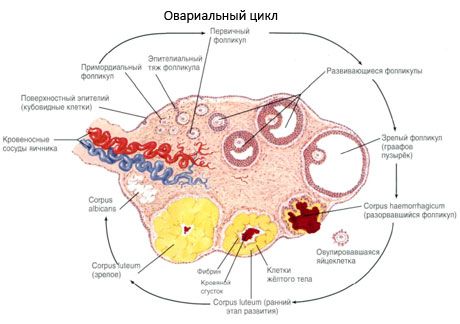
Durante il suo sviluppo, il follicolo attraversa diverse fasi. Le cellule germinali primordiali originano dall'endoderma del sacco vitellino, dall'allantoide, e migrano verso l'area genitale dell'embrione a 5-6 settimane di gravidanza. A seguito della rapida divisione mitotica, che continua dalle 6-8 settimane alle 16-20 settimane di gravidanza, nelle ovaie dell'embrione si formano fino a 6-7 milioni di ovociti, circondati da un sottile strato di cellule della granulosa.
Follicolo preantrale: l'ovocita è circondato da una membrana (zona pellucida). Le cellule della granulosa che circondano l'ovocita iniziano a proliferare; la loro crescita dipende dalle gonadotropine ed è correlata al livello di estrogeni. Le cellule della granulosa sono il bersaglio dell'FSH. Allo stadio di follicolo preantrale, le cellule della granulosa sono in grado di sintetizzare tre classi di steroidi: induce principalmente l'attività dell'aromatasi, il principale enzima che converte gli androgeni in estradiolo. Si ritiene che l'estradiolo sia in grado di aumentare il numero dei propri recettori, esercitando un effetto mitogenico diretto sulle cellule della granulosa, indipendente dall'FSH. È considerato un fattore paracrino che potenzia gli effetti dell'FSH, inclusa l'attivazione dei processi di aromatizzazione.
I recettori dell'FSH compaiono sulle membrane delle cellule della granulosa non appena inizia la crescita del follicolo. Una diminuzione o un aumento dell'FSH porta a una variazione del numero dei suoi recettori. Questa azione dell'FSH è modulata dai fattori di crescita. L'FSH agisce attraverso la proteina G, il sistema dell'adenilato ciclasi. Sebbene la steroidogenesi nel follicolo sia principalmente regolata dall'FSH, molti fattori sono coinvolti in questo processo: canali ionici, recettori tirosin-chinasi, sistema fosfolipasi dei secondi messaggeri.
Il ruolo degli androgeni nello sviluppo precoce del follicolo è complesso. Le cellule della granulosa possiedono recettori per gli androgeni. Questi non solo costituiscono un substrato per l'aromatizzazione indotta dall'FSH in estrogeni, ma possono anche potenziare l'aromatizzazione a basse concentrazioni. Quando i livelli di androgeni aumentano, le cellule della granulosa preantrale scelgono preferenzialmente non la via di aromatizzazione in estrogeni, ma la via più semplice, la 5α-reduttasi, per convertirsi in un androgeno che non può essere convertito in estrogeno, inibendo così l'attività dell'aromatasi. Questo processo inibisce anche la formazione dei recettori per FSH e LH, bloccando così lo sviluppo del follicolo.
Durante il processo di aromatizzazione, il follicolo con alti livelli di androgeni subisce processi di atresia. La crescita e lo sviluppo del follicolo dipendono dalla sua capacità di convertire gli androgeni in estrogeni.
In presenza di FSH, la sostanza dominante nel fluido follicolare saranno gli estrogeni. In assenza di FSH, gli androgeni. L'LH è normalmente assente nel fluido follicolare fino alla metà del ciclo. Non appena il livello di LH aumenta, l'attività mitotica delle cellule della granulosa diminuisce, compaiono alterazioni degenerative e il livello di androgeni nel follicolo aumenta. Il livello di steroidi nel fluido follicolare è superiore a quello plasmatico e riflette l'attività funzionale delle cellule ovariche: cellule della granulosa e della teca. Se l'unico bersaglio dell'FSH sono le cellule della granulosa, allora l'LH ha molti bersagli: cellule della teca, cellule stromali e luteiniche e cellule della granulosa. Sia le cellule della granulosa che quelle della teca hanno la capacità di steroidogenesi, ma l'attività dell'aromatasi predomina nelle cellule della granulosa.
In risposta all'LH, le cellule della teca producono androgeni, che vengono poi convertiti dalle cellule della granulosa in estrogeni attraverso l'aromatizzazione indotta dall'FSH.
Man mano che il follicolo cresce, le cellule della teca iniziano a esprimere geni per i recettori dell'LH, P450 sec e 3beta-idrossisteroide deidrogenasi, fattore di crescita insulino-simile (IGF-1) che in sinergia con l'LH aumenta l'espressione genica, ma non stimola la steroidogenesi.
La steroidogenesi ovarica è sempre dipendente dall'LH. Man mano che il follicolo cresce, le cellule della teca esprimono l'enzima P450c17, che forma androgeni a partire dal colesterolo. Le cellule della granulosa non possiedono questo enzima e dipendono dalle cellule della teca per la produzione di estrogeni a partire dagli androgeni. A differenza della steroidogenesi, la follicologenesi è dipendente dall'FSH. Man mano che il follicolo cresce e i livelli di estrogeni aumentano, si attiva un meccanismo di feedback: la produzione di FSH viene inibita, il che a sua volta porta a una diminuzione dell'attività aromatasica del follicolo e, infine, all'atresia follicolare attraverso l'apoptosi (morte cellulare programmata).
Il meccanismo di feedback degli estrogeni e dell'FSH inibisce lo sviluppo dei follicoli che hanno iniziato a crescere, ma non del follicolo dominante. Il follicolo dominante contiene più recettori per l'FSH, che supportano la proliferazione delle cellule della granulosa e l'aromatizzazione degli androgeni in estrogeni. Inoltre, le vie paracrina e autocrina agiscono come importanti coordinatori dello sviluppo del follicolo antrale.
Il regolatore autocrino/paracrino è costituito da peptidi (inibina, attivina, follistatina), sintetizzati dalle cellule della granulosa in risposta all'FSH ed entrati nel fluido follicolare. L'inibina riduce la secrezione di FSH; l'attivina stimola il rilascio di FSH dall'ipofisi e ne potenzia l'azione nell'ovaio; la follistatina sopprime l'attività dell'FSH, probabilmente legandosi all'attivina. Dopo l'ovulazione e lo sviluppo del corpo luteo, l'inibina è sotto il controllo dell'LH.
La crescita e la differenziazione delle cellule ovariche sono influenzate dai fattori di crescita insulino-simili (IGE). L'IGF-1 agisce sulle cellule della granulosa, causando un aumento di adenosina monofosfato ciclico (cAMP), progesterone, ossitocina, proteoglicano e inibina.
L'IGF-1 agisce sulle cellule della teca, causando un aumento della produzione di androgeni. Le cellule della teca, a loro volta, producono il fattore di necrosi tumorale (TNF) e il fattore di crescita epidermico (EGF), anch'essi regolati dall'FSH.
L'EGF stimola la proliferazione delle cellule della granulosa. L'IGF-2 è il principale fattore di crescita presente nel fluido follicolare, in cui si trovano anche IGF-1, TNF-α, TNF-3 ed EGF.
L'interruzione della regolazione paracrina e/o autocrina della funzione ovarica sembra svolgere un ruolo nei disturbi dell'ovulazione e nello sviluppo delle ovaie policistiche.
Con la crescita del follicolo antrale, il contenuto di estrogeni nel fluido follicolare aumenta. Al culmine del loro aumento, i recettori per l'LH compaiono sulle cellule della granulosa, si verifica la luteinizzazione delle cellule della granulosa e aumenta la produzione di progesterone. Pertanto, nel periodo preovulatorio, un aumento della produzione di estrogeni provoca la comparsa dei recettori per l'LH; l'LH, a sua volta, causa la luteinizzazione delle cellule della granulosa e la produzione di progesterone. Un aumento del progesterone riduce i livelli di estrogeni, il che apparentemente causa un secondo picco di FSH a metà ciclo.
Si ritiene che l'ovulazione avvenga 10-12 ore dopo il picco di LH e 24-36 ore dopo il picco di estradiolo. Si ritiene che l'LH stimoli la divisione cellulare dell'ovocita, la luteinizzazione delle cellule della granulosa e la sintesi di progesterone e prostaglandine nel follicolo.
Il progesterone potenzia l'attività degli enzimi proteolitici, che insieme alle prostaglandine partecipano alla rottura della parete del follicolo. Il picco di FSH indotto dal progesterone consente all'ovocita di uscire dal follicolo convertendo il plasminogeno nell'enzima proteolitico plasmina e fornisce un numero sufficiente di recettori dell'LH per il normale sviluppo della fase luteinica.
Entro 3 giorni dall'ovulazione, le cellule della granulosa aumentano di dimensioni e al loro interno compaiono i caratteristici vacuoli ripieni di pigmento, la luteina. Le cellule teca-luteali si differenziano dalla teca e dallo stroma e diventano parte del corpo luteo. I capillari che penetrano nel corpo luteo si sviluppano molto rapidamente sotto l'influenza di fattori angiogenetici e, con una migliore vascolarizzazione, aumenta la produzione di progesterone ed estrogeni. L'attività della steroidogenesi e la durata della vita del corpo luteo sono determinate dal livello di LH. Il corpo luteo non è una formazione cellulare omogenea. Oltre a 2 tipi di cellule luteali, contiene cellule endoteliali, macrofagi, fibroblasti, ecc. Le cellule luteali grandi producono peptidi (relaxina, ossitocina) e sono più attive nella steroidogenesi con una maggiore attività aromatasica e una maggiore sintesi di progesterone rispetto alle cellule piccole.
Il picco di progesterone si verifica l'ottavo giorno dopo il picco di LH. È stato osservato che progesterone ed estradiolo vengono secreti episodicamente nella fase luteinica in correlazione con la secrezione pulsatile di LH. Con la formazione del corpo luteo, il controllo della produzione di inibina passa dall'FSH all'LH. L'inibina aumenta con l'aumento dell'estradiolo prima del picco di LH e continua ad aumentare dopo il picco di LH, sebbene i livelli di estrogeni diminuiscano. Sebbene inibina ed estradiolo siano secreti dalle cellule della granulosa, sono regolati da vie diverse. Il calo di inibina alla fine della fase luteinica contribuisce all'aumento di FSH per il ciclo successivo.
Il corpo luteo diminuisce molto rapidamente: dal 9° all'11° giorno dopo l'ovulazione.
Il meccanismo di degenerazione non è chiaro e non è correlato al ruolo luteolitico degli estrogeni o a un meccanismo recettoriale, come osservato nell'endometrio. Esiste un'altra spiegazione per il ruolo degli estrogeni prodotti dal corpo luteo. È noto che gli estrogeni sono necessari per la sintesi dei recettori del progesterone nell'endometrio. Gli estrogeni della fase luteale sono probabilmente necessari per i cambiamenti correlati al progesterone nell'endometrio dopo l'ovulazione. Lo sviluppo inadeguato dei recettori del progesterone, come conseguenza di livelli inadeguati di estrogeni, è probabilmente un ulteriore meccanismo di infertilità e aborti precoci, un'altra forma di deficit della fase luteale. Si ritiene che la durata di vita del corpo luteo si stabilizzi al momento dell'ovulazione. E certamente regredirà se non sarà supportata dalla gonadotropina corionica umana a causa della gravidanza. Pertanto, la regressione del corpo luteo porta a una diminuzione dei livelli di estradiolo, progesterone e inibina. Una diminuzione dell'inibina rimuove il suo effetto soppressivo sull'FSH; una diminuzione di estradiolo e progesterone consente un ripristino molto rapido della secrezione di GnRH e l'eliminazione del meccanismo di feedback dall'ipofisi. Una diminuzione di inibina ed estradiolo, insieme a un aumento di GnRH, dà origine a FSH rispetto a LH. Un aumento di FSH porta alla crescita del follicolo con successiva selezione di un follicolo dominante e all'inizio di un nuovo ciclo se la gravidanza non si verifica. Gli ormoni steroidei svolgono un ruolo di primo piano nella biologia riproduttiva e nella fisiologia generale. Determinano il fenotipo umano, influenzano il sistema cardiovascolare, il metabolismo osseo, la pelle, il benessere generale e svolgono un ruolo chiave nella gravidanza. L'azione degli ormoni steroidei riflette i meccanismi intracellulari e genetici necessari per trasmettere un segnale extracellulare al nucleo cellulare per causare una risposta fisiologica.
Gli estrogeni penetrano diffusamente la membrana cellulare e si legano ai recettori situati nel nucleo cellulare. Il complesso recettore-steroide si lega quindi al DNA. Nelle cellule bersaglio, queste interazioni portano all'espressione genica, alla sintesi proteica e a specifiche funzioni cellulari e tissutali.


 [
[