Esperto medico dell'articolo
Nuove pubblicazioni
Patogenesi dell'epatite B
Ultima recensione: 07.07.2025

Tutti i contenuti di iLive sono revisionati o verificati da un punto di vista medico per garantire la massima precisione possibile.
Abbiamo linee guida rigorose in materia di sourcing e colleghiamo solo a siti di media affidabili, istituti di ricerca accademici e, ove possibile, studi rivisti dal punto di vista medico. Nota che i numeri tra parentesi ([1], [2], ecc.) Sono link cliccabili per questi studi.
Se ritieni che uno qualsiasi dei nostri contenuti sia impreciso, scaduto o comunque discutibile, selezionalo e premi Ctrl + Invio.
Nella patogenesi dell'epatite B si possono identificare diversi anelli principali della catena patogenetica:
- introduzione del patogeno - infezione;
- fissazione sull'epatocita e penetrazione nella cellula;
- moltiplicazione del virus e sua “spinta” sulla superficie dell’epatocita, nonché nel sangue;
- attivazione di reazioni immunologiche volte all’eliminazione del patogeno;
- danni da complessi immunitari ad organi e sistemi;
- formazione dell'immunità, liberazione dal patogeno, guarigione.
Poiché l'infezione da epatite B avviene sempre per via parenterale, si può ritenere che il momento dell'infezione equivalga praticamente alla penetrazione del virus nel sangue. I tentativi di alcuni ricercatori di distinguere la fase enterale da quella regionale nell'epatite B sono scarsamente fondati. Vi sono maggiori motivi per ritenere che il virus penetri immediatamente nel fegato attraverso il flusso sanguigno.
Il tropismo del virus dell'epatite B per il tessuto epatico è predeterminato dalla presenza di uno speciale recettore nell'HBsAg, un polipeptide con un peso molecolare di 31.000 Da (P31), dotato di attività legante l'albumina. Una zona di albumina simile si trova anche sulla membrana degli epatociti nel fegato di esseri umani e scimpanzé, il che determina essenzialmente il tropismo dell'HBV per il fegato di esseri umani e scimpanzé.
Quando il virus penetra nell'epatocita, viene rilasciato il DNA virale che, entrando nel nucleo dell'epatocita e fungendo da matrice per la sintesi degli acidi nucleici, innesca una serie di reazioni biologiche sequenziali, il cui risultato è l'assemblaggio del nucleocapside del virus. Il nucleocapside migra attraverso la membrana nucleare nel citoplasma, dove avviene l'assemblaggio finale delle particelle Dane, il virus dell'epatite B completo.
Va notato, tuttavia, che quando un epatocita viene infettato, il processo può procedere in due modi: replicativo e integrativo. Nel primo caso, si sviluppa un quadro di epatite acuta o cronica, e nel secondo, si sviluppa il virus.
Le ragioni che determinano i due tipi di interazione tra DNA virale ed epatociti non sono state stabilite con precisione. Molto probabilmente, il tipo di risposta è determinato geneticamente.
Il risultato dell'interazione replicativa è l'assemblaggio delle strutture antigeniche centrali (nel nucleo) e l'assemblaggio del virus completo (nel citoplasma), seguito dalla presentazione del virus completo o dei suoi antigeni sulla membrana o nella struttura della membrana dell'epatocita.
È generalmente accettato che la replicazione virale non comporti danni cellulari a livello degli epatociti, poiché il virus dell'epatite B non ha un effetto citopatico. Questa posizione non può essere considerata indiscutibile, poiché si basa su dati sperimentali che, sebbene indichino l'assenza di un effetto citopatico del virus dell'epatite B, sono stati ottenuti su colture tissutali e pertanto non possono essere completamente estrapolati all'epatite virale B nell'uomo. In ogni caso, la questione dell'assenza di danni agli epatociti durante la fase replicativa richiede ulteriori studi.
Tuttavia, indipendentemente dalla natura dell'interazione del virus con la cellula, il fegato è necessariamente coinvolto nel processo immunopatologico. In questo caso, il danno agli epatociti è associato al fatto che, a seguito dell'espressione di antigeni virali sulla membrana epatocitaria e del loro rilascio in circolo, si innesca una catena di reazioni immunitarie cellulari e umorali sequenziali, finalizzate in ultima analisi all'eliminazione del virus dall'organismo. Questo processo si svolge nel pieno rispetto dei modelli generali della risposta immunitaria alle infezioni virali. Per eliminare il patogeno, si innescano reazioni citotossiche cellulari, mediate da diverse classi di cellule effettrici: linfociti K, linfociti T, cellule natural killer, macrofagi. Durante queste reazioni, gli epatociti infetti vengono distrutti, con conseguente rilascio di antigeni virali (HBcAg, HBeAg, HBsAg), che innescano il sistema di produzione di anticorpi, a seguito del quale si accumulano nel sangue anticorpi specifici, principalmente contro il nucleo (anti-HBc) e l'antigene e (anti-HBE). Di conseguenza, la cellula epatica viene liberata dal virus e ne determina la morte per reazione di citolisi cellulare.
Allo stesso tempo, anticorpi specifici che si accumulano nel sangue legano gli antigeni virali, formando immunocomplessi che vengono fagocitati dai macrofagi ed escreti dai reni. In questo caso, possono verificarsi diverse lesioni da immunocomplessi, come glomerulonefrite, arterite, artralgia, eruzioni cutanee, ecc. Grazie alla presenza di anticorpi specifici, l'organismo viene purificato dal patogeno e si verifica la completa guarigione.
In accordo con il concetto delineato della patogenesi dell'epatite B, l'intera diversità delle varianti cliniche del decorso della malattia è solitamente spiegata dalle peculiarità dell'interazione del virus e dalla cooperazione delle cellule immunocompetenti, in altre parole, dall'intensità della risposta immunitaria alla presenza di antigeni virali. Secondo le concezioni moderne, l'intensità della risposta immunitaria è geneticamente determinata e correlata agli antigeni di istocompatibilità del locus HLA di prima classe.
È generalmente accettato che, in condizioni di adeguata risposta immunitaria agli antigeni virali, l'epatite acuta si sviluppi clinicamente con un decorso ciclico e una completa guarigione. A fronte di una diminuzione della risposta immunitaria agli antigeni virali, la citolisi immunomediata si manifesta in modo insignificante, pertanto non si verifica un'efficace eliminazione delle cellule epatiche infette, il che porta a lievi manifestazioni cliniche con persistenza a lungo termine del virus e, potenzialmente, allo sviluppo di epatite cronica. Allo stesso tempo, al contrario, in caso di una forte risposta immunitaria geneticamente determinata e di un'infezione massiva (emotrasfusione), si formano estese aree di danno alle cellule epatiche, che clinicamente corrispondono a forme gravi e maligne della malattia.
Lo schema presentato della patogenesi dell'epatite B si distingue per la sua coerenza; contiene tuttavia una serie di punti controversi e poco studiati.
Se consideriamo l'epatite B come una malattia immunopatologica, potremmo aspettarci un aumento delle reazioni di citotossicità cellulare con l'aumentare della gravità della malattia. Tuttavia, nelle forme gravi, gli indici del legame cellulare dell'immunità sono nettamente ridotti, incluso un calo multiplo, rispetto a quelli dei bambini sani, e l'indice di citotossicità delle cellule K. Nella forma maligna, durante il periodo di sviluppo di necrosi epatica massiva e soprattutto di coma epatico, si osserva una completa incapacità dei linfociti di indurre la trasformazione blastica sotto l'influenza di fitoematlutinina, endotossina stafilococcica e HBsAg. Inoltre, non vi è alcuna capacità dei leucociti di migrare secondo la reazione di inibizione della migrazione leucocitaria (LMIC), e un netto aumento della permeabilità delle membrane linfocitarie è stato rivelato secondo i risultati dei loro studi utilizzando una sonda fluorescente a tetraciclina.
Pertanto, se gli indici di fluorescenza dei linfociti nelle persone sane sono pari al 9,9±2% e nell'epatite B tipica con decorso benigno aumentano al 22,3±2,7%, nelle forme maligne il numero di linfociti fluorescenti raggiunge una media del 63,5±5,8%. Poiché un aumento della permeabilità delle membrane cellulari è inequivocabilmente valutato in letteratura come un indicatore affidabile della loro inferiorità funzionale, si può concludere che nell'epatite B, soprattutto nella forma maligna, si verifica un danno grave ai linfociti. Ciò è dimostrato anche dagli indici di citotossicità delle cellule K. Nella forma grave, nella 1a-2a settimana di malattia, la citotossicità è del 15,5±8,8%, nella forma maligna è del 6,0±2,6% nella 1a settimana, del 22,0±6,3% nella 2a, con una norma del 44,8±2,6%.
I dati presentati indicano chiaramente marcati disturbi nel legame cellulare dell'immunità nei pazienti con forme gravi di epatite B. È anche ovvio che questi cambiamenti si verificano secondariamente, a seguito di danni alle cellule immunocompetenti causati da metaboliti tossici e, possibilmente, da immunocomplessi circolanti.
Come hanno dimostrato gli studi, nei pazienti con forme gravi di epatite B, soprattutto in caso di sviluppo di necrosi epatica massiva, il titolo di HBsAg e HBeAg nel siero sanguigno diminuisce e contemporaneamente iniziano a essere rilevati anticorpi contro l'antigene di superficie a titoli elevati, il che è del tutto insolito per le forme benigne della malattia, in cui gli anticorpi anti-HBV compaiono solo nel 3°-5° mese di malattia.
La rapida scomparsa degli antigeni del virus dell'epatite B con la comparsa simultanea di titoli elevati di anticorpi antivirali suggerisce la formazione intensiva di immunocomplessi e la loro possibile partecipazione alla patogenesi dello sviluppo di necrosi epatica massiva.
Pertanto, i dati di fatto non ci consentono di interpretare l'epatite B in modo univoco solo dal punto di vista dell'aggressione immunopatologica. E il punto non è solo che non si riscontra alcuna correlazione tra la profondità e la prevalenza delle alterazioni morfologiche del fegato, da un lato, e la gravità dei fattori di immunità cellulare, dall'altro. Teoricamente, questa circostanza potrebbe essere spiegata dalle fasi avanzate dello studio degli indicatori di immunità cellulare, quando le cellule immunocompetenti erano sottoposte a potenti effetti tossici a causa della crescente insufficienza funzionale del fegato. Naturalmente, si può presumere che la citolisi immunitaria degli epatociti si verifichi nelle fasi più precoci del processo infettivo, forse anche prima della comparsa dei sintomi clinici di grave danno epatico. Tuttavia, tale ipotesi è improbabile, poiché indicatori simili di immunità cellulare sono stati rilevati in pazienti con il decorso più acuto (fulminante) della malattia e, inoltre, durante l'esame morfologico del tessuto epatico, non è stata rilevata un'infiltrazione linfocitaria massiva, mentre allo stesso tempo sono stati rilevati campi continui di epitelio necrotico senza fenomeni di riassorbimento e aggressione linfocitaria.
È molto difficile spiegare il quadro morfologico dell'epatite acuta solo dal punto di vista della citolisi cellulare immunitaria, pertanto, nei primi studi, l'effetto citotossico del virus dell'epatite B non è stato escluso.
Attualmente, questa ipotesi è stata parzialmente confermata dalla scoperta del virus dell'epatite B. Come dimostrato dagli studi, la frequenza di rilevamento dei marcatori dell'epatite D dipende direttamente dalla gravità della malattia: nelle forme lievi, vengono rilevati nel 14%, in quelle moderate nel 18%, in quelle gravi nel 30% e in quelle maligne nel 52%. Considerando che il virus dell'epatite D ha un effetto citopatico necrosogenico, si può ritenere accertato che la coinfezione con i virus dell'epatite B e D sia di grande importanza nello sviluppo delle forme fulminanti di epatite B.
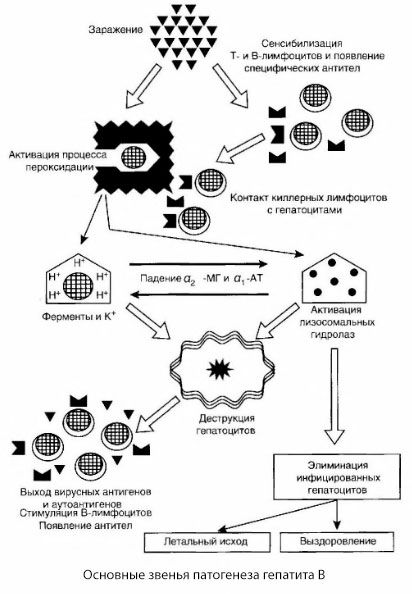
La patogenesi dell'epatite B può essere presentata come segue. Dopo la penetrazione del virus dell'epatite B negli epatociti, viene indotto un attacco immunologico contro gli epatociti infetti da parte di cellule T-killer, che secernono linfotossine in direzione delle cellule epatiche.
I meccanismi intimi del danno epatocitario nell'epatite B non sono ancora stati stabiliti. Il ruolo principale è svolto dai processi attivati di perossidazione lipidica e dalle idrolasi lisosomiali. L'innesco potrebbe essere costituito dalle linfotossine rilasciate dalle cellule effettrici a seguito del contatto con gli epatociti, ma è possibile che il virus stesso sia l'iniziatore dei processi di perossidazione. Successivamente, il processo patologico si sviluppa molto probabilmente secondo la seguente sequenza.
- Interazione del fattore di aggressione (linfotossine o virus) con macromolecole biologiche (eventualmente con componenti delle membrane del reticolo endoplasmatico in grado di partecipare a processi di detossificazione, per analogia con altri agenti lesivi, come è stato dimostrato a proposito del tetracloruro di carbonio).
- Formazione di radicali liberi, attivazione dei processi di perossidazione lipidica e aumento della permeabilità di tutte le membrane epatocellulari (sindrome da citolisi).
- Movimento di sostanze biologicamente attive lungo il gradiente di concentrazione: perdita di enzimi di varie localizzazioni intracellulari, donatori di energia, potassio, ecc. Accumulo di sodio e calcio nelle cellule, spostamento del pH verso l'acidosi intracellulare.
- Attivazione e rilascio di idrolasi lisosomiali (RNAsi, DNAsi, catepsine, ecc.) con rottura delle cellule epatiche e rilascio di autoantigeni.
- Stimolazione dei sistemi immunitari T e B con formazione di una sensibilizzazione specifica dei linfociti T alle lipoproteine epatiche e formazione di autoanticorpi umorali antiepatici.
Nello schema proposto della patogenesi dell'epatite B, il fattore scatenante sono gli antigeni virali, la cui produzione intensiva si osserva nelle fasi più precoci della malattia e durante tutto il periodo acuto, ad eccezione delle forme maligne, in cui la produzione di antigeni virali cessa praticamente al momento dello sviluppo di una massiva necrosi epatica, che predetermina una rapida diminuzione della replicazione virale.
È anche ovvio che gli antigeni virali attivano i sistemi immunitari T e B. Durante questo processo, si verifica una caratteristica ridistribuzione delle sottopopolazioni di linfociti T, volta a organizzare una risposta immunitaria adeguata, eliminando gli epatociti infetti, neutralizzando gli antigeni virali, favorendo la sanogenesi e la guarigione.
Quando le cellule immunocompetenti interagiscono con antigeni virali sulle membrane degli epatociti o durante la riproduzione del virus all'interno di un epatocita, si creano le condizioni per l'attivazione dei processi di perossidazione lipidica, che, come è noto, controllano la permeabilità di tutte le membrane cellulari e subcellulari.
Da questa posizione si comprende il verificarsi della sindrome da citolisi, ovvero l'aumento della permeabilità delle membrane cellulari, così naturale e caratteristica dell'epatite virale.
L'esito finale della sindrome da citolisi potrebbe essere il completo disaccoppiamento della fosforilazione ossidativa, la fuoriuscita di materiale cellulare e la morte del parenchima epatico.
Tuttavia, nella stragrande maggioranza dei casi, questi processi non assumono un decorso così fatale. Solo nelle forme maligne della malattia il processo patologico procede in modo a valanga e irreversibile, poiché si verificano un'infezione massiva, un'intensa risposta immunitaria, un'eccessiva attivazione dei processi di perossidazione e delle idrodasi lisosomiali e fenomeni di aggressione autoimmune.
Gli stessi meccanismi si osservano nel decorso favorevole dell'epatite B, con l'unica particolarità di essere tutti realizzati a un livello qualitativamente diverso. A differenza dei casi di necrosi epatica massiva, nel decorso favorevole della malattia il numero di epatociti infetti, e quindi la zona di citolisi immunopatologica, è inferiore, i processi di perossidazione lipidica non sono significativamente potenziati, l'attivazione delle idrolasi acide porta solo a un'autolisi limitata con un rilascio insignificante di autoantigeni e, quindi, senza autoaggressione massiva, ovvero tutte le fasi della patogenesi nel decorso favorevole si svolgono nell'ambito dell'organizzazione strutturale preservata del parenchima epatico e sono frenate dai sistemi di difesa (antiossidanti, inibitori, ecc.) e quindi non hanno un effetto così distruttivo.
Le cause dei sintomi di intossicazione nell'epatite virale non sono state completamente studiate. La proposta di distinguere tra la cosiddetta intossicazione primaria, o virale, e quella secondaria (da scambio, o metabolica) può essere considerata positiva, sebbene ciò non riveli il meccanismo intimo dell'insorgenza della sindrome tossica generale. In primo luogo, i virus dell'epatite non hanno proprietà tossiche e, in secondo luogo, la concentrazione di molti metaboliti non è sempre correlata alla gravità della malattia e al grado di espressione dei sintomi di tossicosi. È anche noto che la concentrazione di antigeni virali non è strettamente correlata alla gravità dell'intossicazione. Al contrario, con l'aumentare della gravità della malattia e, di conseguenza, del grado di tossicosi, la concentrazione di HBsAg diminuisce e raggiunge i livelli minimi nelle forme maligne al momento dell'insorgenza del coma epatico profondo. Allo stesso tempo, la frequenza di rilevamento e i titoli di anticorpi antivirali specifici dipendono direttamente dalla gravità della malattia.
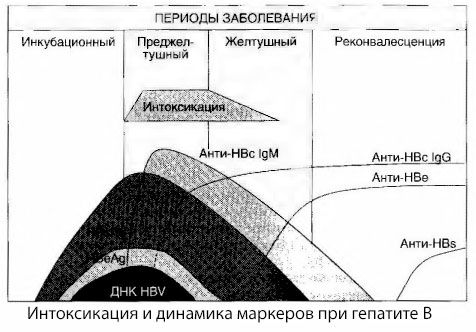
L'intossicazione non si manifesta al momento della registrazione degli antigeni virali, ma durante il periodo di circolazione nel sangue degli anticorpi antivirali di classe IgM contro l'antigene bovino e l'antigene del sistema E. Inoltre, nelle forme gravi e soprattutto maligne, una percentuale significativa di pazienti presenta addirittura anticorpi anti-HBs nel sangue, cosa che di solito non si osserva mai nelle forme lievi e moderate della malattia.
I dati presentati ci permettono di concludere che la sindrome da tossicosi nell'epatite virale, e in particolare nell'epatite B, non si manifesta a seguito della comparsa di antigeni virali nel sangue, ma è conseguenza dell'interazione degli antigeni virali con anticorpi antivirali di classe IgM. Il risultato di tale interazione, come è noto, è la formazione di immunocomplessi e, possibilmente, di sostanze tossiche attive.
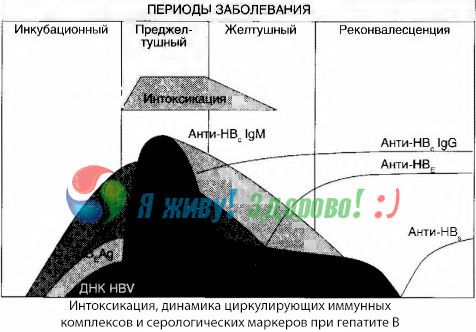
I sintomi di intossicazione si manifestano al momento della comparsa dei complessi immunitari nella libera circolazione, ma successivamente tale correlazione non si osserva.
Una spiegazione parziale di ciò può essere trovata nello studio della composizione degli immunocomplessi. Nei pazienti con forme gravi, nel sangue circolano prevalentemente complessi di medie dimensioni e, nella loro composizione, al culmine della sindrome tossica, predominano gli anticorpi della classe IgG, mentre durante il periodo di declino delle manifestazioni cliniche e di convalescenza, i complessi diventano più grandi e, nella loro composizione, iniziano a predominare gli anticorpi della classe IgG.
I dati presentati riguardano i meccanismi di sviluppo della sindrome tossica nel periodo iniziale della malattia, ma nella tossicosi che si verifica al culmine delle manifestazioni cliniche, hanno solo un significato parziale, e in particolare nello sviluppo del coma epatico.
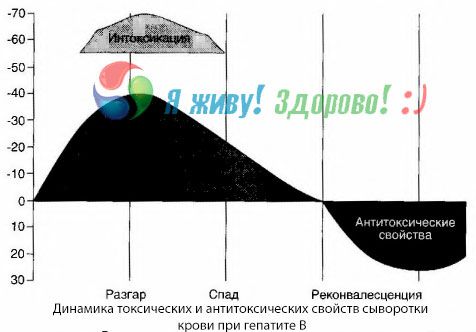
Il metodo delle emocolture ha dimostrato che, in caso di epatite B, le tossine si accumulano costantemente nel sangue, rilasciate dal tessuto epatico danneggiato e in decomposizione. La concentrazione di queste tossine è proporzionale alla gravità della malattia e sono di natura proteica.
Durante il periodo di recupero, nel sangue compaiono anticorpi contro questa tossina; ma in caso di coma epatico, la concentrazione della tossina nel sangue aumenta bruscamente e gli anticorpi non vengono rilevati nel sangue.
Patomorfologia dell'epatite B
In base alla natura delle alterazioni morfologiche si distinguono tre forme di epatite B acuta:
- forma ciclica,
- necrosi epatica massiva;
- Epatite pericholangiolitica colestatica.
Nella forma ciclica dell'epatite B, le alterazioni distrofiche, infiammatorie e proliferative sono più pronunciate al centro dei lobuli, mentre nell'epatite A sono localizzate lungo la periferia del lobulo, diffondendosi verso il centro. Queste differenze sono spiegate dalle diverse vie di penetrazione del virus nel parenchima epatico. Il virus dell'epatite A entra nel fegato attraverso la vena porta e si diffonde al centro dei lobuli, mentre il virus dell'epatite B penetra attraverso l'arteria epatica e i rami capillari che irrorano uniformemente tutti i lobuli, fino al loro centro.
Il grado di danno al parenchima epatico nella maggior parte dei casi corrisponde alla gravità delle manifestazioni cliniche della malattia. Nelle forme lievi, si osserva solitamente una necrosi focale degli epatociti, mentre nelle forme moderate e gravi si osserva una necrosi zonale (con tendenza a fondersi e formare una necrosi a ponte nelle forme gravi della malattia).
Le maggiori alterazioni morfologiche del parenchima si osservano al culmine delle manifestazioni cliniche, che di solito coincide con la prima decade di malattia. Durante la seconda e soprattutto la terza decade, i processi di rigenerazione si intensificano. In questo periodo, le alterazioni necrobiotiche scompaiono quasi completamente e i processi di infiltrazione cellulare iniziano a predominare, con un lento successivo ripristino della struttura delle placche epatocellulari. Tuttavia, il completo ripristino della struttura e della funzione del parenchima epatico si verifica solo 3-6 mesi dopo l'insorgenza della malattia e non in tutti i pazienti.
La natura generalizzata dell'infezione nell'epatite B è confermata dal rilevamento dell'HBsAg non solo negli epatociti, ma anche nei reni, nei polmoni, nella milza, nel pancreas, nelle cellule del midollo osseo, ecc.
L'epatite colestatica (pericolangiolitica) è una forma particolare della malattia, in cui le maggiori alterazioni morfologiche si riscontrano a livello dei dotti biliari intraepatici, con un quadro di colangiolite e pericolangiolite. Nella forma colestatica, la colestasi si manifesta con dilatazione dei capillari biliari con stasi biliare al loro interno, con proliferazione di colangioli e infiltrati cellulari attorno ad essi. Le cellule epatiche sono colpite in modo insignificante in questa forma di epatite. Clinicamente, la malattia è caratterizzata da un decorso protratto con ittero prolungato. È stato dimostrato che la causa di questo peculiare decorso della malattia è l'effetto predominante del virus sulle pareti del colangiolo, con un effetto trascurabile sugli epatociti.

