Esperto medico dell'articolo
Nuove pubblicazioni
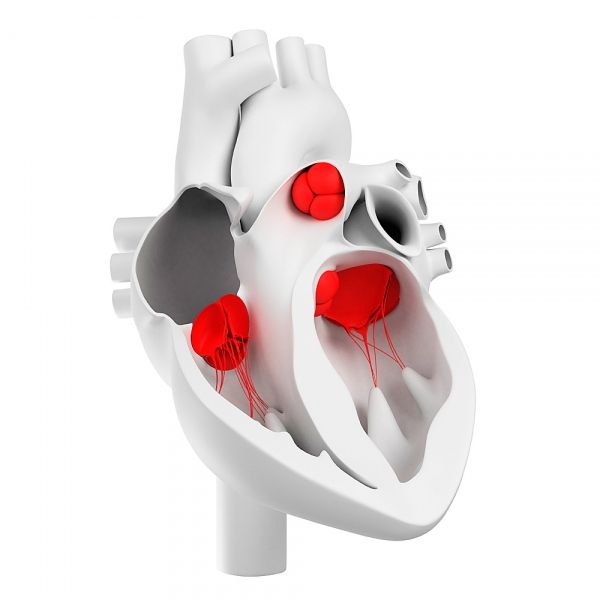
Valvole cardiache
Ultima recensione: 04.07.2025

Tutti i contenuti di iLive sono revisionati o verificati da un punto di vista medico per garantire la massima precisione possibile.
Abbiamo linee guida rigorose in materia di sourcing e colleghiamo solo a siti di media affidabili, istituti di ricerca accademici e, ove possibile, studi rivisti dal punto di vista medico. Nota che i numeri tra parentesi ([1], [2], ecc.) Sono link cliccabili per questi studi.
Se ritieni che uno qualsiasi dei nostri contenuti sia impreciso, scaduto o comunque discutibile, selezionalo e premi Ctrl + Invio.
In precedenza si credeva che tutte le valvole cardiache fossero strutture semplici il cui contributo al flusso sanguigno unidirezionale fosse semplicemente il movimento passivo in risposta a un gradiente di pressione applicato. Questa comprensione delle "strutture passive" ha portato allo sviluppo di sostituti valvolari meccanici e biologici "passivi".
Sta diventando sempre più evidente che le valvole cardiache hanno una struttura e una funzione più complesse. Pertanto, la creazione di un sostituto valvolare cardiaco "attivo" presuppone una significativa somiglianza strutturale e funzionale con la valvola cardiaca naturale, che in futuro sarà piuttosto realistica grazie allo sviluppo dell'ingegneria tissutale.
Le valvole cardiache si sviluppano da rudimenti embrionali di tessuto mesenchimale durante la formazione dell'endocardio. Durante la morfogenesi, si formano il canale atrioventricolare (valvole cardiache tricuspide e mitrale) e il tratto di efflusso ventricolare (valvole cardiache aortica e polmonare).
Come sono disposte le valvole cardiache?
Lo studio dell'afflusso di sangue alle valvole fu avviato da N. Luschka (1852), che iniettò una massa di contrasto nei vasi cardiaci. Scoprì numerosi vasi sanguigni nelle cuspidi delle valvole atrioventricolari e semilunari dell'aorta e dell'arteria polmonare. Allo stesso tempo, numerosi manuali di anatomia patologica e istologia contenevano indicazioni del fatto che le valvole cardiache umane immodificate non contengono vasi sanguigni, e questi ultimi compaiono nelle valvole solo in caso di vari processi patologici: aterosclerosi ed endocardite di varia eziologia. Le informazioni sull'assenza di vasi sanguigni si basavano principalmente su studi istologici. Si presumeva che, in assenza di vasi sanguigni nella parte libera delle cuspidi, la loro nutrizione avvenisse filtrando il fluido dal plasma sanguigno che le lava. Fu notata la penetrazione di alcuni vasi, insieme a fibre di tessuto muscolare striato, nelle basi delle valvole e nelle corde tendinee.
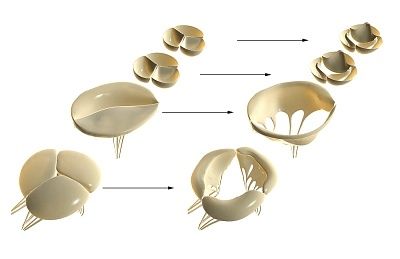
Tuttavia, iniettando nei vasi cardiaci vari coloranti (inchiostro di china in gelatina, bismuto in gelatina, sospensione acquosa di inchiostro nero di china, soluzioni di carminio o blu di tripano), si è scoperto che i vasi penetrano nelle valvole cardiache atrioventricolari, nelle valvole aortiche e nell'arteria polmonare insieme al tessuto muscolare cardiaco, leggermente prima di raggiungere il bordo libero della valvola.
Nel tessuto connettivo fibroso lasso delle cuspidi della valvola atrioventricolare sono stati riscontrati singoli vasi principali anastomizzati con vasi in aree adiacenti del tessuto muscolare striato cardiaco.
Il numero maggiore di vasi sanguigni si trovava alla base e un numero comparativamente inferiore nella parte libera di queste valvole.
Secondo K.I. Kulchitsky et al. (1990), nella valvola mitrale si riscontra un diametro maggiore dei vasi arteriosi e venosi. Alla base delle cuspidi di questa valvola si trovano principalmente i vasi principali con una stretta rete di capillari ad ansa, che penetrano nella parte basale della cuspide e occupano il 10% della sua area. Nella valvola tricuspide, i vasi arteriosi hanno un diametro inferiore rispetto alla valvola mitrale. Nelle cuspidi di questa valvola si trovano principalmente vasi sparsi e anse di capillari sanguigni relativamente ampie. Nella valvola mitrale, la cuspide anteriore è irrorata più intensamente, mentre nella valvola tricuspide le cuspidi anteriore e posteriore, che svolgono la principale funzione di chiusura. Il rapporto tra i diametri dei vasi arteriosi e venosi nelle valvole atrioventricolari del cuore delle persone mature è di 1:1,5. Le anse capillari sono poligonali e si trovano perpendicolarmente alla base delle cuspidi valvolari. I vasi formano una rete planare situata sotto l'endotelio sul lato atriale. I vasi sanguigni si trovano anche nelle corde tendinee, dove penetrano dai muscoli papillari dei ventricoli destro e sinistro a una distanza fino al 30% della lunghezza delle corde tendinee. Numerosi vasi sanguigni formano anse arcuate alla base delle corde tendinee. Le valvole cardiache dell'aorta e del tronco polmonare differiscono significativamente dalle valvole atrioventricolari in termini di apporto ematico. I vasi principali di diametro relativamente inferiore si avvicinano alla base delle cuspidi semilunari delle valvole dell'aorta e del tronco polmonare. I rami brevi di questi vasi terminano in anse capillari di forma ovale irregolare e poligonale. Si trovano principalmente in prossimità della base delle cuspidi semilunari. Anche i vasi venosi alla base delle valvole aortica e polmonari hanno un diametro inferiore rispetto a quelli alla base delle valvole atrioventricolari. Il rapporto tra i diametri dei vasi arteriosi e venosi nelle valvole aortica e polmonari del cuore di persone mature è di 1:1,4. Brevi rami laterali si estendono dai vasi più grandi, terminando in anse capillari di forma ovale e poligonale irregolare.

Con l'età, si verifica un ingrossamento delle fibre del tessuto connettivo, sia collagene che elastico, nonché una diminuzione della quantità di tessuto connettivo fibroso lasso non formato, con conseguente sclerosi del tessuto delle cuspidi valvolari atrioventricolari e delle cuspidi semilunari delle valvole aortiche e polmonari. La lunghezza delle fibre muscolari striate cardiache nelle valvole diminuisce e, di conseguenza, la loro quantità e il numero di vasi sanguigni che penetrano nelle valvole cardiache diminuiscono. A causa di questi cambiamenti, le valvole cardiache perdono le loro proprietà elastiche e resilienti, il che influisce sul meccanismo di chiusura valvolare e sull'emodinamica.
Le valvole cardiache presentano reti di capillari linfatici e un piccolo numero di vasi linfatici dotati di valvole. I capillari linfatici delle cuspidi hanno un aspetto caratteristico: il loro lume è molto irregolare, lo stesso capillare in diverse aree ha un diametro diverso. Nei punti in cui più capillari si uniscono, si formano delle dilatazioni, lacune di varie forme. Le anse delle reti sono spesso poligonali irregolari, più raramente ovali o rotonde. Spesso le anse delle reti linfatiche non sono chiuse e i capillari linfatici terminano ciecamente. Le anse dei capillari linfatici sono orientate il più delle volte nella direzione dal bordo libero della cuspide alla sua base. In alcuni casi, è stata riscontrata una rete di capillari linfatici a doppio strato nelle cuspidi della valvola atrioventricolare.
I plessi nervosi endocardici sono localizzati nei suoi vari strati, principalmente sotto l'endotelio. Sul margine libero delle cuspidi valvolari, le fibre nervose sono disposte principalmente radialmente, connettendosi con quelle delle corde tendinee. Più vicino alla base delle cuspidi, si forma un plesso nervoso a maglie larghe, che si collega al plesso situato attorno agli anelli fibrosi. Sulle cuspidi semilunari, la rete nervosa endocardica è più rada. Nel punto di inserzione delle valvole, diventa densa e multistratificata.
Struttura cellulare delle valvole cardiache
Le cellule interstiziali valvolari, responsabili del mantenimento della struttura della valvola, hanno una forma allungata con numerosi processi sottili che si estendono attraverso la matrice valvolare. Esistono due popolazioni di cellule interstiziali valvolari che differiscono per morfologia e struttura; una ha proprietà contrattili ed è caratterizzata dalla presenza di fibrille contrattili, l'altra ha proprietà secretorie e presenta un reticolo endoplasmatico e un apparato di Golgi ben sviluppati. La funzione contrattile resiste alla pressione emodinamica ed è ulteriormente supportata dalla produzione di proteine contrattili sia cardiache che scheletriche, che includono le catene pesanti di alfa- e beta-miosina e varie isoforme di troponina. La contrazione del lembo valvolare cardiaco è stata dimostrata in risposta a numerosi agenti vasoattivi, suggerendo uno stimolo biologico coordinato per il corretto funzionamento della valvola.
Le cellule interstiziali sono anche componenti essenziali del sistema di riparazione di strutture come le valvole cardiache. Il movimento costante dei lembi valvolari e la conseguente deformazione del tessuto connettivo producono danni a cui le cellule interstiziali valvolari rispondono per preservare l'integrità della valvola. Il processo di riparazione sembra essere vitale per la normale funzionalità valvolare e l'assenza di queste cellule negli attuali modelli di valvole artificiali è probabilmente un fattore che contribuisce al danno strutturale delle bioprotesi.
Un'importante area di ricerca sulle cellule interstiziali è lo studio delle interazioni tra queste e la matrice circostante mediate dalle molecole di adesione focale. Le adesioni focali sono siti specializzati di interazione cellula-matrice che collegano il citoscheletro cellulare alle proteine della matrice tramite le integrine. Agiscono anche come siti di trasduzione del segnale, trasmettendo informazioni meccaniche dalla matrice extracellulare che possono suscitare risposte tra cui, a titolo esemplificativo ma non esaustivo, adesione cellulare, migrazione, crescita e differenziazione. Comprendere la biologia cellulare delle cellule interstiziali valvolari è fondamentale per chiarire i meccanismi attraverso i quali queste cellule interagiscono tra loro e con il loro ambiente, in modo che questa funzione possa essere riprodotta nelle valvole artificiali.
In relazione allo sviluppo di una promettente direzione nell'ingegneria tissutale delle valvole cardiache, gli studi sulle cellule interstiziali vengono condotti utilizzando un'ampia gamma di tecniche. La presenza del citoscheletro cellulare è confermata dalla colorazione per vimentina, desmina, troponina, alfa-actina e miosina muscolare liscia, catene pesanti di alfa- e beta-miosina, catene leggere-2 della miosina cardiaca, alfa- e beta-tubulina. La contrattilità cellulare è confermata da una risposta positiva ad adrenalina, angiotensina II, bradichinina, carbacolo, cloruro di potassio, endotelio I. Le interrelazioni cellulari sono determinate dalle interazioni dei gap funzionali e verificate mediante microiniezioni di carbossifluoresceina. La secrezione della matrice è stabilita dalla colorazione per prolil-4-idrossilasi/collagene di tipo II, fibronectina, condroitin solfato, laminina. L'innervazione è determinata dalla vicinanza delle terminazioni nervose motorie, che si riflette nell'attività del neuropeptide Y (tirosina idrossilasi), dell'acetilcolinesterasi, del polipeptide intestinale vasoattivo, della sostanza P e del peptide correlato al gene del capsicum. I fattori mitogenici sono stimati dal fattore di crescita derivato dalle piastrine, dal fattore di crescita dei fibroblasti basici e dalla serotonina (5-HT). I fibroblasti delle cellule interstiziali studiati sono caratterizzati da una membrana basale incompleta, lunghi e sottili processi citoplasmatici, una stretta connessione con la matrice, un reticolo endoplasmatico irregolare e un apparato di Golgi ben sviluppati, una ricchezza di microfilamenti e la formazione di legami adesivi.
Le cellule endocardiche valvolari formano una guaina aterotrombogenica funzionale attorno a ciascuna valvola cardiaca, simile all'endotelio vascolare. Il metodo di sostituzione valvolare, ampiamente utilizzato, elimina la funzione protettiva dell'endocardio, che può portare alla deposizione di piastrine e fibrina sulle valvole artificiali, allo sviluppo di infezioni batteriche e alla calcificazione dei tessuti. Un'altra probabile funzione di queste cellule è la regolazione delle cellule interstiziali valvolari sottostanti, simile alla regolazione delle cellule muscolari lisce da parte dell'endotelio. Esistono complesse interazioni tra l'endotelio e le cellule adiacenti, mediate in parte da fattori solubili secreti dalle cellule endoteliali. Queste cellule formano un'ampia superficie ricoperta di microprotrusioni sul lato luminale, aumentando così l'esposizione e la possibile interazione con le sostanze metaboliche presenti nel sangue circolante.
L'endotelio presenta spesso differenze morfologiche e funzionali causate da sollecitazioni di taglio sulla parete vasale dovute al flusso sanguigno, e questo vale anche per le cellule endocardiche valvolari, che assumono una forma allungata o poligonale. Cambiamenti nella struttura cellulare possono verificarsi a causa dell'azione dell'emodinamica locale sui componenti del citoscheletro cellulare o per effetti secondari causati da cambiamenti nella matrice extracellulare sottostante. A livello ultrastrutturale, le cellule endocardiche valvolari possiedono connessioni intercellulari, vescicole plasmatiche, un reticolo endoplasmatico rugoso e un apparato di Golgi. Sebbene producano il fattore di von Willebrand sia in vivo che in vitro, sono prive di corpi di Weibel-Palade (granuli specifici contenenti il fattore di von Willebrand), che sono organelli caratteristici dell'endotelio vascolare. Le cellule endocardiche valvolari sono caratterizzate da giunzioni robuste, interazioni funzionali e pieghe marginali sovrapposte.
Le cellule endocardiche mantengono la loro attività metabolica anche in vitro: producono fattore di von Willebrand, prostaciclina, ossido nitrico sintasi, mostrano attività enzimatica di conversione dell'angiotensina e secernono intensamente le molecole di adesione ICAM-1 ed ELAM-1, importanti per il legame con le cellule mononucleate durante lo sviluppo di una risposta immunitaria. Tutti questi marcatori dovrebbero essere tenuti in considerazione quando si coltiva una coltura cellulare ideale per la creazione di una valvola artificiale mediante ingegneria tissutale, ma il potenziale immunostimolante delle cellule endocardiche valvolari stesse potrebbe limitarne l'utilizzo.
La matrice extracellulare delle valvole cardiache è costituita da macromolecole fibrose di collagene ed elastina, proteoglicani e glicoproteine. Il collagene rappresenta il 60% del peso secco della valvola, l'elastina il 10% e i proteoglicani il 20%. La componente di collagene fornisce la principale stabilità meccanica della valvola ed è rappresentata da collageni di tipo I (74%), II (24%) e V (2%). I fasci di filamenti di collagene sono circondati da una guaina di elastina, che media le interazioni tra di essi. Le catene laterali di glicosaminoglicani delle molecole di proteoglicano tendono a formare una sostanza gelatinosa in cui altre molecole della matrice interagiscono per formare legami permanenti e altri componenti si depositano. I glicosaminoglicani delle valvole cardiache umane sono costituiti principalmente da acido ialuronico, in misura minore da dermatan solfato, condroitin-4-solfato e condroitin-6-solfato, con una quantità minima di eparan solfato. Il rimodellamento e il rinnovamento del tessuto della matrice sono regolati dalle metalloproteinasi della matrice (MMP) e dai loro inibitori tissutali (TI). Queste molecole sono inoltre coinvolte in una più ampia gamma di processi fisiologici e patologici. Alcune metalloproteinasi, tra cui le collagenasi interstiziali (MMP-1, MMP-13) e le gelatinasi (MMP-2, MMP-9) e i loro inibitori tissutali (TI-1, TI-2, TI-3), sono presenti in tutte le valvole cardiache. L'eccessiva produzione di metalloproteinasi è caratteristica delle condizioni patologiche della valvola cardiaca.
 [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
[ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
Valvole cardiache e la loro struttura morfologica
Le valvole cardiache sono costituite da tre strati della matrice dei lembi morfologicamente diversi e funzionalmente significativi: fibroso, spugnoso e ventricolare.
Lo strato fibroso forma una struttura resistente al carico per il lembo valvolare, costituita da strati di fibre di collagene. Queste fibre sono disposte radialmente in pieghe per consentire alle valvole arteriose di allungarsi durante la chiusura. Lo strato fibroso si trova in prossimità della superficie esterna di sbocco di queste valvole. Lo strato fibroso delle valvole atrioventricolari funge da continuazione dei fasci di collagene delle corde tendinee. Si trova tra lo strato spugnoso (di ingresso) e quello ventricolare (di uscita).
Tra lo strato fibroso e quello ventricolare si trova lo strato spugnoso (spongiosa). Lo strato spugnoso è costituito da tessuto connettivo scarsamente organizzato in un mezzo viscoso. I componenti principali della matrice di questo strato sono i proteoglicani con collagene orientato casualmente e sottili strati di elastina. Le catene laterali delle molecole di proteoglicano hanno una forte carica negativa, che ne compromette l'elevata capacità di legare l'acqua e formare un gel di matrice poroso. Lo strato spugnoso della matrice riduce lo stress meccanico nei lembi delle valvole cardiache e ne mantiene la flessibilità.
Lo strato ventricolare è molto più sottile degli altri ed è ricco di fibre elastiche che consentono al tessuto di resistere alla deformazione costante. L'elastina ha una struttura spugnosa che circonda e connette le fibre di collagene, mantenendole in uno stato di ripiegamento neutro. Lo strato di ingresso della valvola (ventricolare - per le valvole arteriose e spugnoso - per quelle atrioventricolari) contiene più elastina rispetto allo strato di uscita, il che contribuisce ad attenuare lo shock idraulico quando le cuspidi si chiudono. Questa relazione tra collagene ed elastina consente alle cuspidi di allungarsi fino al 40% senza deformarsi stabilmente. Quando esposte a un piccolo carico, le strutture di collagene di questo strato si orientano nella direzione del carico, aumentando la resistenza a un'ulteriore crescita del carico.
Pertanto, l'idea delle valvole cardiache come semplici duplicazioni endocardiche non è solo semplificata, ma anche sostanzialmente errata. Le valvole cardiache sono organi complessi che includono fibre muscolari striate, vasi sanguigni e linfatici ed elementi nervosi. Sia nella loro struttura che nel loro funzionamento, le valvole sono parte integrante di tutte le strutture cardiache. L'analisi della normale funzione valvolare deve tenere conto della sua organizzazione cellulare, nonché dell'interazione delle cellule tra loro e con la matrice. Le conoscenze acquisite da tali studi sono all'avanguardia nella progettazione e nello sviluppo di protesi valvolari mediante l'ingegneria tissutale.

