Esperto medico dell'articolo
Nuove pubblicazioni
Farmaci
Farmaci che prevengono la trombosi e migliorano la reologia del sangue
Ultima recensione: 07.07.2025

Tutti i contenuti di iLive sono revisionati o verificati da un punto di vista medico per garantire la massima precisione possibile.
Abbiamo linee guida rigorose in materia di sourcing e colleghiamo solo a siti di media affidabili, istituti di ricerca accademici e, ove possibile, studi rivisti dal punto di vista medico. Nota che i numeri tra parentesi ([1], [2], ecc.) Sono link cliccabili per questi studi.
Se ritieni che uno qualsiasi dei nostri contenuti sia impreciso, scaduto o comunque discutibile, selezionalo e premi Ctrl + Invio.
Nella prevenzione della formazione di microtrombi multipli durante lo shock e della loro distruzione, possono essere utilizzati vari approcci farmacologici che utilizzano farmaci che prevengono la formazione di trombi e migliorano la reologia del sangue:
- eliminazione dei disturbi emodinamici e microcircolatori sistemici mediante agenti vasoattivi e inotropi;
- misure per migliorare la reologia del sangue utilizzando una terapia infusionale razionale e farmaci che ripristinano l'elasticità delle membrane eritrocitarie (trental o pentossifillina);
- prevenzione dell’aggregazione piastrinica e della formazione di trombi “bianchi” iniziali nei piccoli vasi arteriosi con successivo inizio della cascata della coagulazione;
- inibizione della formazione di trombi dopo l'attivazione della cascata sistemica della coagulazione;
- attivazione della fibrinolisi con lo scopo di sciogliere i coaguli di sangue di nuova formazione (fibrinolisina, streptochinasi, streptodecasi, urochinasi, ecc.) o, al contrario, inibizione della fibrinolisi quando è generalizzata in alcuni pazienti con shock traumatico e sepsi (acido aminocaproico, amben, contrical, ecc.).
La maggior parte degli approcci elencati sono tradizionali, ben sviluppati nella pratica del trattamento dello shock, hanno le proprie indicazioni emoreologiche e sono specificati nei capitoli pertinenti. Pertanto, in questa sezione è consigliabile soffermarsi sull'approccio generale alla prevenzione della formazione di trombi nello shock mediante l'impiego di agenti farmacologici che influenzano la profase della coagulazione del sangue. È proprio questo livello di prevenzione delle complicanze della coagulazione – la comparsa, la formazione e la crescita di "trombi arteriosi bianchi" – ad attirare la maggiore attenzione dei ricercatori.
Diversi tipi di shock sono caratterizzati da disturbi della coagulazione del sangue, spesso multidirezionali, con deterioramento della reologia. Il più caratteristico degli shock settici, da endotossina, da ustione, traumatici ed emorragici è la formazione di microtrombi multipli nei vasi più piccoli, causati da disturbi dell'emodinamica sistemica, vasospasmo e disturbi della microcircolazione, ispessimento del sangue, fango ematico, ridotta elasticità delle membrane eritrocitarie, nonché da numerosi fattori generali e locali (autocoidi) che innescano alterazioni locali nell'emostasi coagulativa e l'inclusione della profase della coagulazione del sangue.
In forma schematica (abbreviata), la fase iniziale dell'emocoagulazione e il meccanismo dell'omeostasi dell'emocoagulazione locale sono presentati di seguito.
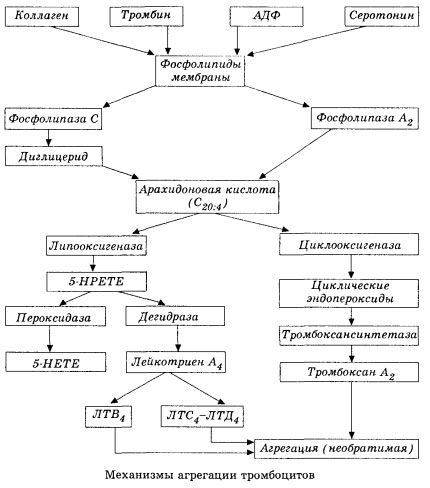
Inizia con l'attivazione della fosfolipasi di membrana A2 a seguito dell'impatto di una combinazione di fattori dannosi (danno diretto alla membrana, ipossia, perossidazione lipidica, impatto di fattori chimici endogeni, ecc.). A seguito della degradazione dei fosfolipidi di membrana, vengono rilasciati acidi grassi a catena lunga non esterificati, di cui l'acido arachidonico è il più importante come substrato iniziale. La sua trasformazione (cascata dell'acido arachidonico) avviene attraverso le vie lipoossigenasiche (sintesi di leucotrieni) e cicloossigenasiche (sintesi di prostaglandine, trombossani, prostacicline).
I leucotrieni risultanti (B4, C4, E4, D4, ecc.) - sostanze ad altissima attività biologica, tra cui la sostanza a reazione lenta responsabile dell'anafilassi - svolgono un ruolo fondamentale nell'innesco di reazioni vascolari, infiammatorie e immunitarie locali, compresi i processi autoimmuni. I leucotrieni causano disturbi del microcircolo, aumento della coagulazione del sangue, rilascio di enzimi lisosomiali autolitici e rilascio nel sangue di un fattore che inibisce la contrattilità miocardica e lo spasmo bronchiale.
Grazie alla loro capacità di indurre la contrazione della muscolatura liscia, i leucotrieni influenzano significativamente l'emodinamica sistemica, i vasi coronarici e il miocardio, esercitando un potente effetto costrittore coronarico e un effetto inotropo negativo, che si accompagna a una diminuzione della gittata cardiaca e svolge un ruolo importante nello sviluppo dell'ipotensione.
La riduzione della gittata cardiaca e la risposta ipotensiva ai leucotrieni sono associate all'indebolimento del muscolo cardiaco e alla limitazione del ritorno venoso al cuore. Di notevole importanza nel limitare il ritorno venoso è la capacità dei leucotrieni di aumentare la permeabilità della parete vascolare e causare stravaso plasmatico. I leucotrieni sono considerati importanti nella patogenesi dell'infarto miocardico.
Nello shock anafilattico e settico (da endotossina), il loro ruolo apparentemente aumenta ulteriormente, come dimostrato dalla capacità dei leucotrieni di accumularsi in quantità significative nel plasma durante le reazioni allergiche e di causare alterazioni del flusso ematico sistemico caratteristiche dello shock anafilattico, nonché dagli effetti protettivi dei bloccanti del recettore dei leucotrieni e degli inibitori della lipoossigenasi. Lo sviluppo di bloccanti selettivi del recettore dei leucotrieni è in corso a un ritmo piuttosto intenso e rappresenta una promettente direzione scientifica. In questo ambito, sono già stati ottenuti alcuni successi e l'efficacia di tali bloccanti nell'ischemia miocardica, nell'endotossina e nello shock emorragico è stata confermata sperimentalmente. Tuttavia, probabilmente ci vorranno ancora diversi anni prima che questa direzione trovi implementazione clinica.
Se nei vasi venosi i trombi si formano con la partecipazione paritaria di trombociti e fattori della coagulazione plasmatici, nelle arterie i trombociti sono i principali iniziatori del processo. Contengono ADP, Ca2+, serotonina, fosfolipidi, enzimi di sintesi di prostaglandine e trombossano, trombostenina (che, come l'actomiosina muscolare, conferisce la capacità contrattile a queste cellule), fattore di crescita trombogenico delle cellule epiteliali e muscolari della parete vascolare e numerose altre sostanze. La regolazione umorale delle funzioni dei trombociti avviene attraverso recettori specializzati presenti sulle loro membrane (adrenorecettori alfa2 e beta2, recettori per l'istamina e la serotonina, acetilcolina, trombossano, adenosina e molti altri). Una proprietà speciale dei trombociti è l'elevata affinità per il collagene e altri elementi subendoteliali della parete vascolare, per superfici non bagnabili e caricate negativamente. Questa proprietà conferisce ai trombociti un'eccezionale capacità di aderire (attaccarsi) a una sezione di un vaso con endotelio danneggiato, che ha ampie possibilità di essere danneggiato durante lo shock. In questo caso, i trombociti si diffondono e rilasciano pseudopodi, che possono aderire tra loro e alla parete del vaso. La permeabilità della membrana aumenta e ADP, serotonina, trombossano e alcuni fattori della coagulazione adsorbiti sulla superficie del trombocita vengono rilasciati dai trombociti. Queste sostanze interagiscono con i corrispondenti recettori sulla membrana e, con la partecipazione degli ioni calcio, causano l'aggregazione (inizialmente reversibile). Il processo diventa autosostenibile, facilitato da fattori regolatori umorali; altri fattori, al contrario, possono arrestarlo e persino invertirlo, causando la disaggregazione.
Con il prevalere di influenze e condizioni che favoriscono la formazione di trombi, le fasi di adesione e di aggregazione reversibile vengono sostituite dalla terza fase: aggregazione irreversibile, che si realizza con la partecipazione della trombostenina e porta alla costrizione del coagulo; la reazione di rafforzamento dell'aggregante e di costrizione avviene anch'essa con la partecipazione di Ca+, ATP e porta alla formazione di un trombo bianco.
La via della cicloossigenasi nella conversione dell'acido arachidonico nelle piastrine, nelle cellule endoteliali vascolari e in altri tessuti garantisce l'omeostasi locale della coagulazione (l'emivita dei metaboliti è molto breve), poiché durante questo metabolismo si formano potenti sostanze pro- e antiaggreganti. Il principale fattore che attiva l'aggregazione piastrinica nella catena di reazioni della cicloossigenasi è il trombossano A2, e il suo antagonista non meno potente è la prostaciclina, prodotta dalle cellule endoteliali e, in misura minore, dalle prostaglandine delle serie E e G. Infine, l'aggregazione piastrinica è fortemente influenzata da ulteriori fattori umorali locali e sistemici.
Attivatori e inibitori dell'aggregazione piastrinica
Iniziatori e attivatori dell'aggregazione piastrinica |
Inibitori dell'aggregazione piastrinica |
Collagene |
- |
ADP |
Adenosina e i suoi stabilizzatori |
Noradrenalina (tramite i recettori alfa2) |
Agenti bloccanti alfa-adrenergici |
Serotonina |
Agenti antiserotonina |
Istamina |
Antistaminici |
Trombina |
Eparina |
Ca2+ |
Antagonisti del Ca2+ |
CGMP - i suoi induttori (acetilcolina?) e stabilizzatori |
CAM - i suoi induttori (tramite i recettori beta-adrenergici) e stabilizzatori (inibitori della fosfodiesterasi) |
Acido arachidonico |
Destrani, albumina |
Trombossano A2 |
Prostaciclina I2 |
Gli interventi farmacologici nella fase iniziale della formazione del trombo nello shock e nei processi ischemici acuti nel cuore e nel cervello suggeriscono la seguente possibilità:
- inibizione delle reazioni iniziali (totali e parziali) della cascata dell'acido arachidonico;
- inibizione di una particolare reazione di sintesi del trombossano;
- blocco dei recettori per i leucotrieni e i trombossani nelle piastrine, nella muscolatura liscia e in altre cellule;
- l'uso di sostanze che modulano l'aggregazione piastrinica, cioè indeboliscono in altri modi la reazione di queste all'influenza dei fattori iniziatici (collagene, trombossano A2, leucotrieni, ecc.).
L'implementazione dei metodi elencati per la correzione dei disturbi delle proprietà reologiche del sangue consente di risolvere il principale compito tattico: proteggere i recettori di aggregazione e adesione piastrinica dall'azione degli attivatori o sopprimere i meccanismi intracellulari di sintesi di questi recettori. L'inibizione delle reazioni iniziali della cascata dell'acido arachidonico può essere ottenuta proteggendo i recettori piastrinici che reagiscono agli attivatori polimerici, utilizzando destrani a basso peso molecolare, le cui molecole competono con fibrina, collagene, immunoglobuline aggregate (IgE) e componenti del sistema del complemento.
Mascherando i recettori sulla membrana piastrinica e competendo con le proteine a grande dispersione sulla superficie degli eritrociti, i destrani a basso peso molecolare li sostituiscono e distruggono i ponti di collegamento tra le cellule. Ciò è dovuto al fatto che i destrani, avvolgendo l'endotelio vascolare e la superficie degli elementi cellulari del sangue, ne aumentano la carica negativa, potenziando così le proprietà antiaggreganti.
Destrani
I destrani a basso peso molecolare riducono l'aggregazione piastrinica indotta dal collagene e dall'ADP, nonché l'effetto attivante della trombina sulle piastrine, inibiscono la crescita del trombo piastrinico bianco iniziale, migliorano il flusso sanguigno, riducono l'aumento postoperatorio del contenuto di fibrinogeno plasmatico e modificano la struttura e la stabilità della fibrina.
Le infusioni endovenose di destrani in caso di trauma e shock non solo riducono l'aggregazione e l'adesione piastrinica, ma mobilizzano anche l'eparina endogena, promuovendo così la formazione di un coagulo sanguigno lasso e difficilmente retrattile, facilmente lisabile dai fibrinolitici. L'attività antitrombinica dei destrani a basso peso molecolare è associata al loro effetto specifico sulla struttura e sulla funzione del fattore VIII della coagulazione del sangue. Il fattore VIII (globulina antiemofilica), una molecola di grandi dimensioni con struttura e funzione complesse, è coinvolto nell'aggregazione piastrinica e nella stabilità del coagulo risultante. I destrani interferiscono con l'azione del fattore VIII, rallentando così l'aggregazione piastrinica e riducendo la stabilità del coagulo.
I destrani a basso peso molecolare non sono veri anticoagulanti e il loro effetto correttivo nei disturbi emoreologici è associato principalmente all'emodiluizione, al ripristino del volume plasmatico circolante e al miglioramento del flusso sanguigno nel sistema microcircolatorio.
La capacità dei destrani di migliorare il flusso sanguigno in caso di disturbi emodinamici (shock, emorragia) è dovuta a un complesso di fattori. Il verificarsi di un'elevata concentrazione transitoria del polimero nel sangue non solo porta a una "emodiluizione diretta", ma crea anche le condizioni per il flusso di fluido dallo spazio interstiziale al flusso sanguigno e il successivo bilanciamento dell'effetto osmotico del destrano. Come conseguenza dell'emodiluizione, la viscosità del sangue diminuisce, l'afflusso venoso al cuore aumenta e la gittata cardiaca aumenta. Oltre a questi effetti, i destrani formano complessi con il fibrinogeno e hanno un effetto antilipemico.
Pertanto, l'azione antiaggregante e gli effetti emodinamici dei destrani a basso peso molecolare contribuiscono a ridurre la viscosità del sangue, fattore particolarmente importante a basse velocità di taglio. La disaggregazione delle cellule del sangue migliora il flusso sanguigno sistemico e la microcircolazione, soprattutto nel suo tratto venoso, dove i gradienti di velocità sono più bassi. L'uso di soluzioni di destrano a basso peso molecolare in vari tipi di shock, durante il trattamento chirurgico delle lesioni e delle loro conseguenze, e nel periodo postoperatorio, aiuta a prevenire l'ipercoagulazione e a ridurre la probabilità di processi trombotici ed embolie.
Tuttavia, è opportuno notare che in alcuni casi le infusioni di soluzioni di destrano sono accompagnate da reazioni anafilattiche e allergiche (pericolose in presenza di sensibilizzazione e shock anafilattico). Ciò è dovuto al fatto che i destrani, che hanno un elevato peso molecolare e numerose catene laterali, possono agire come antigeni. Pertanto, per stabilire la sensibilità individuale, si raccomanda di pre-somministrare per via endovenosa fino a 20 ml di una soluzione di destrano a basso peso molecolare come aptene (soluzione al 15%, peso molecolare 1000) ed effettuare infusioni di un sostituto del plasma prima dell'introduzione dell'anestesia.
 [ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ]
[ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ]
Inibitori della trombina
La protezione farmacologica dei recettori piastrinici che interagiscono con gli attivatori piastrinici può essere ottenuta anche utilizzando agenti che competono con gli attivatori piastrinici non polimerici o li inibiscono. Tra questi agenti figurano gli inibitori della trombina (eparina e irudina, diversi inibitori sintetici, antagonisti dell'adrenalina), i bloccanti dei recettori alfa (fentolamina, diidroergotamina), gli antagonisti dell'ADP (dipiridamolo, adenosina e i suoi analoghi strutturali, fosfocreatina), gli antagonisti della serotonina (metisergide). Solo alcuni degli agenti elencati sono effettivamente utilizzati per la prevenzione e la terapia dello shock di varia origine.
La protezione dei meccanismi intracellulari di sintesi dei recettori proteici che reagiscono con gli attivatori dell'aggregazione e dell'adesione piastrinica e l'inibizione dei processi di sintesi del trombossano sono possibili con farmaci di vari gruppi:
- induttori e stabilizzatori di cATP, prostaciclina e prostaglandina PgE2;
- inibitori della fosfolipasi e della fosfodiesterasi.
Lo sviluppo intensivo di specifici agenti antipiastrinici è iniziato relativamente di recente e non ha ancora prodotto risultati affidabili. Attualmente, nella pratica clinica, oltre alle soluzioni di destrano, agenti antipiastrinici come acido acetilsalicilico, indometacina, dipiradamolo, sulfinpirazone (persantin), prostaciclina (eicoprostenone) ed eparina sono ampiamente utilizzati per prevenire la formazione di trombi piastrinici bianchi.
Farmaci antinfiammatori non steroidei
È stato dimostrato che gli effetti farmacologici dei farmaci antinfiammatori non steroidei (FANS) - acido acetilsalicilico e indometacina - sono dovuti al loro effetto sul metabolismo degli eicosanoidi (trombossani e prostaglandine). Quasi tutti i farmaci di questo gruppo inibiscono il complesso enzimatico noto come prostaglandina sintetasi, esercitando così i loro effetti specifici e antiaggreganti.
L'acido acetilsalicilico viene assorbito molto rapidamente dopo somministrazione orale. Il prodotto della sua idrolisi, l'acido salicilico, causa l'inibizione della cicloossigenasi piastrinica, che interrompe la conversione dell'acido arachidonico in prostaglandina O₂ e, infine, in trombossano A₂. L'acido acetilsalicilico inibisce l'aggregazione indotta da collagene, ADP, adrenalina e serotonina. Sebbene il suo GG0₂ sia di 15 minuti, l'effetto antiaggregante dura per diversi giorni, il che è apparentemente spiegato dall'inibizione irreversibile delle reazioni di sintesi delle prostaglandine e dalla soppressione della funzione di aggregazione piastrinica per tutta la loro vita (6-10 giorni). Oltre all'inibizione della cicloossigenasi piastrinica, l'acido acetilsalicilico ad alte dosi inibisce la cicloossigenasi della parete vascolare e, contemporaneamente alla soppressione della sintesi di trombossano A₂, inibisce la sintesi di prostaciclina nelle cellule endoteliali. Pertanto, l'acido acetilsalicilico dovrebbe essere prescritto come antiaggregante in piccole dosi (3000-5000 mg/die), che inibiscono prevalentemente l'aggregazione piastrinica.
Considerando che l'acido acetilsalicilico blocca la cicloossigenasi piastrinica per diversi giorni e la cicloossigenasi endoteliale per non più di un giorno, è razionale prescrivere il farmaco non quotidianamente, ma ogni 3-4 giorni. La scelta della dose ottimale di acido acetilsalicilico per ogni paziente deve essere effettuata individualmente, poiché esiste una diversa sensibilità dei pazienti all'effetto antiaggregante del farmaco. Nei pazienti reattivi, l'acido acetilsalicilico alla dose di 0,5 g inibisce l'aggregazione piastrinica del 40-50%, nei pazienti iperreattivi completamente o dell'80-90%, e nei pazienti iperreattivi, l'assenza di un effetto antiaggregante è caratteristica a parità di dose del farmaco.
Gli inibitori selettivi della trombossano sintetasi sono l'imidazolo e i suoi analoghi, che non bloccano la cicloossigenasi. Il dipiridamolo, utilizzato nella pratica clinica nel trattamento della cardiopatia ischemica cronica come dilatatore coronarico, inibisce selettivamente, come l'imidazolo, la trombossano sintetasi, impedendo la sintesi di trombossano A2. Si ritiene che il farmaco e i suoi analoghi inibiscano anche la fosfodiesterasi piastrinica, aumentando così la concentrazione di cAMP nelle piastrine. Oltre a ciò, il dipiridamolo inibisce l'attività dell'adenosina deaminasi e la captazione di adenosina da parte delle piastrine, bloccando l'assorbimento della serotonina da parte delle piastrine e la loro aggregazione indotta da adrenalina e collagene. Sono stati segnalati una debole attività antipiastrinica del farmaco e la sua capacità, a piccole dosi, di aumentare l'aggregazione piastrinica. L'effetto antipiastrinico più affidabile si può ottenere con una combinazione di dipiridamolo e acido acetilsalicilico.
Eparina
Tra gli agenti antitrombotici, uno dei regolatori più efficaci dello stato di aggregazione del sangue è l'eparina, soprattutto se utilizzata precocemente. L'eparina ha un'elevata carica negativa ed è in grado di interagire con ioni e molecole sia grandi che piccole (enzimi, ormoni, ammine biogene, proteine plasmatiche, ecc.), quindi lo spettro della sua azione biologica è piuttosto ampio. Il farmaco ha effetti antitrombinici, antitromboplastinici e antiprotrombinici, previene la conversione del fibrinogeno in fibrina, sopprime la retrazione del coagulo e aumenta la fibrinolisi.
Il meccanismo d'azione anticoagulante dell'eparina è piuttosto complesso. È stato ormai accertato che gli effetti anticoagulanti dell'eparina sono associati al potenziamento dell'azione dell'antitrombina III e al potenziamento della capacità del complesso eparina-antitrombina III di inattivare rapidamente la maggior parte delle serin-proteasi del sistema di coagulazione del sangue. Nell'effetto antitrombotico dell'eparina, la sua capacità di aumentare e mantenere un elevato potenziale elettronegativo dell'intima vascolare, prevenendo l'adesione piastrinica e la formazione di microtrombi piastrinici, è di grande importanza. L'eparina sopprime in modo particolarmente attivo la formazione di trombi nelle vene, prevenendo sia la formazione di trombi locali che la coagulazione intravascolare disseminata.
Prostaciclina e i suoi analoghi stabili
Tra gli agenti antiaggreganti piastrinici, i più potenti inibitori dell'aggregazione sono la prostaciclina e i suoi analoghi stabili. L'effetto antiaggregante della prostaciclina è dovuto alla stimolazione dell'adenilato ciclasi e, di conseguenza, all'aumento della concentrazione di cAMP nelle piastrine, alla diminuzione del contenuto di trombossano, alla diminuzione del contenuto di trombossano A2 e al blocco dei suoi recettori. La prostaciclina è instabile e si idrolizza rapidamente in prodotti inattivi, pertanto viene somministrata per via endovenosa a goccia a una velocità compresa tra 2 e 20 ng/kg al minuto per 30-60 minuti fino a 6 volte al giorno.
La prostaciclina, oltre a un forte effetto antiaggregante, ha un potente effetto vasodilatatore e broncodilatatore. Il farmaco dilata i vasi del cervello, del cuore, dei reni, dei muscoli scheletrici e dei vasi mesenterici. Sotto l'influenza della prostaciclina, il flusso sanguigno coronarico aumenta, l'apporto energetico del miocardio aumenta e il suo fabbisogno di ossigeno diminuisce. Nonostante la sua instabilità nell'organismo, gli effetti clinicamente favorevoli possono durare per diverse settimane e persino mesi. Il meccanismo di tale azione prolungata non è ancora chiaro.
La prostaciclina è un farmaco a bassa tossicità, ma il suo uso può causare effetti collaterali: rossore al viso, mal di testa, calo della pressione sanguigna, dolore addominale, anoressia. Oltre alla prostaciclina, i suoi analoghi sintetici stabili (iloprost, ecc.) sono promettenti inibitori dell'aggregazione piastrinica.
Farmaci che migliorano la viscosità del sangue
Le alterazioni delle proprietà reologiche del sangue durante traumi e shock sono causate non solo da alterazioni dell'attività funzionale delle piastrine, ma anche da un aumento della viscosità del sangue. La viscosità strutturale del sangue, in quanto sistema dinamico complesso e disperso, è determinata in larga misura dalla viscosità del plasma e dalla capacità degli eritrociti di deformarsi. La viscosità plasmatica dipende principalmente dalla concentrazione delle proteine nel sangue. Le proteine a basso peso molecolare, come l'albumina, hanno scarso effetto sulla viscosità plasmatica, mentre le proteine a grande peso molecolare (fibrinogeno, alfa- e gamma-globuline, altre macromolecole) la aumentano significativamente.
A basse velocità di taglio, l'adsorbimento di fibrinogeno e globuline sulla superficie degli eritrociti porta alla formazione di ponti tra cellule adiacenti e alla formazione di aggregati eritrocitari. La velocità di formazione degli aggregati è un processo biofisico complesso e dipende non solo dall'entità del taglio, ma anche dalle proprietà elettrocinetiche degli eritrociti, dalla concentrazione, dalla massa e dalla capacità di assorbimento delle macromolecole-aggreganti, dalla forma e dalla plasticità degli eritrociti.
Mantenere la forma e le proprietà meccaniche della membrana eritrocitaria richiede un notevole dispendio energetico. Si ritiene che l'energia prodotta negli eritrociti durante la glicolisi venga spesa per la fosforilazione della spettrina, che determina cambiamenti nella struttura secondaria della proteina e nell'interazione con i componenti adiacenti della membrana interna. L'interazione tra le proteine strutturali della membrana, spettrina e actina, svolge un ruolo importante nella formazione delle proprietà meccaniche della membrana eritrocitaria, nel mantenimento di un'area superficiale e di uno spessore costanti dell'eritrocita sotto qualsiasi deformazione.
In caso di disturbi emodinamici sistemici e del flusso sanguigno d'organo, l'aumento della rigidità delle membrane eritrocitarie e la formazione di aggregati eritrocitari portano a una riduzione della velocità di passaggio degli eritrociti attraverso i capillari, compromettendo così la funzione di trasporto dei gas nel sangue. Pertanto, la correzione dei disturbi delle proprietà reologiche del sangue in stato di shock dovrebbe includere, oltre alla prevenzione dell'aggregazione eritrocitaria, la normalizzazione della viscosità plasmatica ed ematica, l'aggregazione e la deformazione degli eritrociti.
Oltre ai destrani a basso peso molecolare, le soluzioni di albumina rappresentano uno dei mezzi più efficaci per aumentare la stabilità della sospensione del sangue. Nella fase tardiva dello shock, si verifica un'aggregazione generalizzata degli eritrociti, in concomitanza con una diminuzione della concentrazione di albumina nel plasma sanguigno e un aumento della concentrazione di fibrinogeno e globuline, in particolare la frazione alfa2, lipoproteine e lipidi. In queste condizioni, gli effetti reologici dell'albumina sono dovuti a due fattori principali: l'emodiluizione e la normalizzazione del rapporto tra proteine micro e macroglobulari nel plasma. Allo stesso tempo, l'albumina lega gli acidi liberi, la cui labilizzazione durante traumi e shock stimola l'aggregazione delle strutture cellulari del sangue e la coagulazione intravascolare, e può causare embolia grassa.
Le misure anti-shock volte a ripristinare il volume del sangue circolante, eliminando l'ipossia tissutale e l'acidosi metabolica, contribuiscono alla normalizzazione dell'elasticità delle membrane eritrocitarie, poiché ipossia e acidosi riducono significativamente la deformabilità degli eritrociti. L'aumentata rigidità delle membrane eritrocitarie in stato di shock è probabilmente associata all'inibizione della sintesi di ATP negli eritrociti. A sua volta, una diminuzione della concentrazione di ATP contribuisce a un aumento della concentrazione di Ca2+ negli eritrociti, che, legandosi alle proteine di membrana, ne aumenta la rigidità.
Uno dei farmaci farmacologici che aumenta il contenuto di ATP negli eritrociti e l'elasticità delle membrane eritrocitarie è il Trental (pentossifillina), utilizzato nella pratica clinica per trattare i disturbi ischemici.
Oltre a ridurre la rigidità delle membrane degli eritrociti, Trental provoca vasodilatazione, migliora l'ossigenazione dei tessuti, inibisce l'attività della fosfodiesterasi nei tessuti, aumenta la concentrazione di cAMP e inibisce l'aggregazione piastrinica.
Tra gli altri agenti farmacologici che mantengono l'elasticità della membrana eritrocitaria, vale la pena menzionare gli antagonisti del Ca2+, che limitano il flusso di ioni negli eritrociti (flunarizina, nifedipina, ecc.).
 [ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ]
[ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ]
Attenzione!
Per semplificare la percezione delle informazioni, questa istruzione per l'utilizzo del farmaco "Farmaci che prevengono la trombosi e migliorano la reologia del sangue" è stata tradotta e presentata in una forma speciale sulla base delle istruzioni ufficiali per l'uso medico del farmaco. Prima dell'uso leggere l'annotazione che è arrivata direttamente al farmaco.
Descrizione fornita a scopo informativo e non è una guida all'autoguarigione. La necessità di questo farmaco, lo scopo del regime di trattamento, i metodi e la dose del farmaco sono determinati esclusivamente dal medico curante. L'automedicazione è pericolosa per la tua salute.

