Esperto medico dell'articolo
Nuove pubblicazioni
Ruolo delle alterazioni dell'osso subcondrale nella patogenesi dell'osteoartrite
Ultima recensione: 04.07.2025

Tutti i contenuti di iLive sono revisionati o verificati da un punto di vista medico per garantire la massima precisione possibile.
Abbiamo linee guida rigorose in materia di sourcing e colleghiamo solo a siti di media affidabili, istituti di ricerca accademici e, ove possibile, studi rivisti dal punto di vista medico. Nota che i numeri tra parentesi ([1], [2], ecc.) Sono link cliccabili per questi studi.
Se ritieni che uno qualsiasi dei nostri contenuti sia impreciso, scaduto o comunque discutibile, selezionalo e premi Ctrl + Invio.
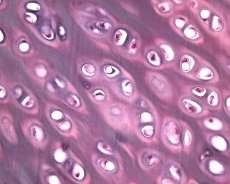
Oltre alla degenerazione della cartilagine articolare, anche il tessuto osseo sottostante è coinvolto nel processo patologico dell'osteoartrosi. Si presume che l'ispessimento della placca subcondrale contribuisca alla progressione dell'osteoartrosi. Con il progredire dell'osteoartrosi, la cartilagine articolare, soggetta a stress meccanici e chimici, si erode lentamente a causa di uno squilibrio nei processi di catabolismo e riparazione della cartilagine. In particolare, lo stress meccanico in relazione alle articolazioni che "sopportano" il peso corporeo contribuisce alla formazione di un gran numero di microfratture nella placca subcondrale e nella cartilagine. Con l'erosione della cartilagine articolare, progredisce la sclerosi dell'osso subcondrale, aumentando la rigidità del tessuto osseo, che a sua volta contribuisce a un'ulteriore disgregazione della struttura della cartilagine articolare. Tuttavia, la questione della natura primaria o secondaria delle alterazioni dell'osso subcondrale nell'osteoartrosi rimane irrisolta.
Fino a poco tempo fa, alterazioni radiograficamente rilevabili nella sostanza spugnosa dell'osso subcondrale, come la sclerosi o la formazione di cisti, erano considerate secondarie nei pazienti con osteoartrosi. Tuttavia, i risultati di studi clinici e sperimentali indicano un possibile ruolo iniziale dell'osso subcondrale nella patogenesi dell'osteoartrosi. Uno dei possibili meccanismi è un forte aumento del gradiente di rigidità dell'osso subcondrale dovuto al fatto che l'integrità del tessuto cartilagineo sottostante dipende dalle proprietà meccaniche del suo "letto" osseo. Studi sui primati hanno dimostrato che le alterazioni dell'osso subcondrale possono precedere le alterazioni della cartilagine articolare. Le prove a favore e contro questa ipotesi emerse a seguito di studi su modelli animali di osteoartrosi e studi clinici non hanno fatto che intensificare il dibattito. L'ispessimento delle trabecole nell'osso subcondrale non è sempre accompagnato da un aumento della mineralizzazione ossea, o meglio, da un aumento del volume dell'osteoide. Questo segno di mineralizzazione anomala indica che il disturbo della regolazione del rimodellamento osseo è parte integrante dell'osteoartrite e supporta anche il concetto di difetto delle cellule ossee nell'osteoartrite. Il gruppo di J. Dequeker (1989) considera quest'ultima una "malattia metabolica ossea generalizzata".
Il tessuto osseo si rinnova costantemente. Questo processo dinamico, chiamato rimodellamento osseo, è una complessa sequenza di riassorbimento e mineralizzazione. Gli osteoclasti riassorbono il tessuto osseo e gli osteoblasti secernono proteine che costituiscono la principale componente organica per la mineralizzazione. La formazione e il riassorbimento osseo non avvengono casualmente in tutto lo scheletro; è un processo programmato che si verifica in diverse aree dello scheletro, chiamate unità di rimodellamento osseo. All'inizio del ciclo, gli osteoclasti compaiono sulla superficie inattiva; entro 2 settimane, formano un tunnel nell'osso corticale o una lacuna sulla superficie dell'osso trabecolare. La frequenza di attivazione delle nuove unità di rimodellamento osseo determina il grado di rinnovamento osseo. In una persona giovane e sana, i processi di formazione e riassorbimento osseo sono bilanciati e viene mantenuta una massa ossea normale. Alla regolazione ormonale del riassorbimento del tessuto osseo partecipano, almeno per quanto riguarda il PTH e la PGE2 , non solo gli osteoclasti ma anche gli osteoblasti, poiché sotto l'influenza di questi ormoni vengono rilasciati fattori che stimolano il riassorbimento osseo da parte degli osteoclasti. Attualmente sono noti più di 12 regolatori locali e sistemici della crescita del tessuto osseo che ne influenzano il rimodellamento, in particolare PTH, 1,25(OH)2D3 ,calcitonina, ormone della crescita, glucocorticoidi, ormoni tiroidei, insulina, IGF(1 e 2), estrogeni, PGE2 , androgeni.
Le cellule ossee rilasciano diverse proteine e citochine che svolgono la regolazione endocrina e la trasduzione del segnale. Le proteine prodotte dagli osteoblasti includono proteine della matrice ossea come collagene, osteopontina, osteocalcina e sialoproteine ossee. Inoltre, queste cellule rilasciano proteasi, sia in forma attiva che latente, che partecipano al processo di rimodellamento del tessuto osseo: le MMP, componenti del sistema attivatore del plasminogeno (PA)/plasmina. Le citochine rilasciate dagli osteoblasti possono agire sia attraverso meccanismi autocrini che paracrini sulle cellule locali (altri osteoblasti, osteoclasti).
Non è ancora noto se questi segnali siano regolati dallo stress meccanico o da altri segnali chimici indotti dallo stress meccanico. Tuttavia, è noto che lo stress meccanico ripetuto causa la proliferazione locale di cellule e/o proteine ossee. In vivo, il carico meccanico può attivare gli osteoblasti, aumentare il livello di nucleotidi ciclici, la produzione di prostaglandine e causare cambiamenti morfologici associati al rimodellamento osseo. In vitro, lo stress meccanico causa la proliferazione di colture di osteoblasti, l'espressione di mRNA di proteine ossee coinvolte nella formazione e mineralizzazione degli osteoidi, il rilascio di fattori di crescita locali come IGF-1 e IGF-2 e molecole di adesione. La trasmissione del segnale di stress meccanico può essere effettuata attraverso canali ionici meccanosensibili.
Esistono prove indirette di disfunzione osteoblastica nell'osteoartrosi. G. Gevers e J. Dequeker (1987) hanno dimostrato un aumento dei livelli sierici di osteocalcina in donne con osteoartrosi della mano, così come in espianti ossei corticali, indicando che la patologia ossea potrebbe essere parte dell'osteoartrosi. L'autopsia ha rivelato non solo un ispessimento dell'osso subcondrale, ma anche una mineralizzazione anormalmente bassa della testa femorale. Nelle cavie con osteoartrosi indotta chirurgicamente, la tomografia computerizzata ha rivelato un significativo ispessimento della frazione ossea nella zona subcondrale. Uno squilibrio tra collagene e proteine non collageniche (osteocalcina, ecc.) può portare a un aumento del volume osseo, ma non ne influenza la densità minerale. Secondo M. Shimizu et al. (1993), la progressione delle alterazioni degenerative della cartilagine articolare è associata a un rimodellamento più intenso dell'osso subcondrale e a un aumento della sua rigidità, che indica anche un difetto nelle cellule del tessuto osseo nell'osteoartrosi. Secondo l'ipotesi proposta da B. Lee e M. Aspden (1997), la proliferazione di cellule ossee difettose può portare a un aumento della rigidità del tessuto osseo, ma non causa un aumento della sua densità minerale.
CI Westacott et al. (1997) hanno ipotizzato che gli osteoblasti anomali influenzino direttamente il metabolismo della cartilagine. Coltivando osteoblasti di pazienti con osteoartrite con condrociti di persone non affette da patologie articolari, gli autori hanno osservato un cambiamento significativo nel rilascio di glicosaminoglicani da parte del tessuto cartilagineo normale in vitro, ma il livello di rilascio di citochine è rimasto invariato. G. Hilal et al. (1998) hanno dimostrato che la coltura di osteoblasti di osso subcondrale di pazienti con osteoartrite in vitro presenta un metabolismo alterato: l'attività del sistema AP/plasmina e il livello di IGF-1 in queste cellule risultano aumentati. L'osservazione di CI Westacott et al. (1997) può essere spiegata da un aumento dell'attività delle proteasi nelle cellule ossee subcondrali.
Non è noto se le alterazioni dell'osso subcondrale inducano l'osteoartrite o ne contribuiscano alla progressione. DK Dedrick et al. (1993) hanno dimostrato che nei cani con osteoartrite indotta chirurgicamente, l'ispessimento dell'osso subcondrale non è una condizione necessaria per lo sviluppo di alterazioni simil-osteoartrosiche nella cartilagine articolare, ma contribuisce alla progressione dei processi degenerativi nella cartilagine. I risultati dello studio di A. Sa'ied et al. (1997) contraddicono i dati dello studio precedente. Utilizzando l'ecografia a 50 MHz per valutare le alterazioni morfologiche iniziali e la loro progressione nella cartilagine articolare e nell'osso nell'osteoartrite sperimentale indotta da iniezioni di acido monoiodoacetico nell'articolazione del ginocchio di ratti, gli autori hanno dimostrato un processo simultaneo di alterazioni nell'osso e nella cartilagine durante i primi tre giorni dopo l'iniezione.
Gli osteoblasti secernono fattori di crescita e citochine coinvolti nel rimodellamento osseo locale, che possono promuovere il rimodellamento della cartilagine corretta nelle articolazioni "portanti" dopo la loro penetrazione attraverso microfratture nello strato calcificato della cartilagine articolare. Inoltre, i prodotti di secrezione delle cellule ossee si trovano nel liquido sinoviale. I prodotti secreti dagli osteoblasti anomali più probabilmente in grado di avviare il processo di rimodellamento cartilagineo locale sono il TGF-β e le proteine morfometriche ossee (BMP). Entrambi i membri della famiglia dei TGF sono secreti sia dai condrociti che dagli osteoblasti, ed entrambi sono in grado di modificare il rimodellamento sia osseo che cartilagineo. J. Martel Pelletier et al. (1997) hanno osservato un aumento del livello di TGF-β negli espianti ossei subcondrali di pazienti con osteoartrosi rispetto a individui sani, il che indica un probabile ruolo di questo fattore di crescita nella patogenesi dell'osteoartrosi. Anche gli IGF sono prodotti dagli osteoblasti. In una coltura di cellule simili agli osteoblasti ottenute da pazienti affetti da osteoartrosi, è stato riscontrato un aumento del livello di IGF, che alterano il metabolismo della cartilagine.
TGF-β, IGF, BMP e citochine prodotte dagli osteoblasti nell'osso subcondrale possono influenzare la produzione di collagenasi e di altri enzimi proteolitici nella cartilagine, che a loro volta possono promuovere il rimodellamento/degradazione della matrice cartilaginea. Non è ancora chiaro se gli osteoblasti nell'OA producano meno fattore stimolante le colonie di macrofagi (M-CSF, uno stimolatore del riassorbimento osseo) rispetto alle cellule normali. I risultati degli studi di AG Uitterlinden et al. (1997) hanno dimostrato che i recettori della vitamina D, espressi dagli osteoblasti e che regolano l'espressione di numerosi fattori sintetizzati da queste cellule, possono svolgere un ruolo nella formazione degli osteofiti, il che spiega in parte il ruolo degli osteoblasti nella patogenesi di questa malattia.
Tenendo conto dei risultati degli studi sopracitati, G. Hilal et al. (1998), J. Martel-Pelletier et al. (1997) hanno proposto la seguente ipotesi di lavoro sulla relazione tra il rimodellamento dell'osso subcondrale e la cartilagine articolare propria nell'osteoartrosi. In una fase precoce o avanzata della patogenesi dell'OA, il processo di rimodellamento del tessuto osseo nell'osso subcondrale si intensifica. Allo stesso tempo, carichi ripetuti portano a microfratture locali e/o alla comparsa di uno squilibrio nel sistema IGF/proteina legante l'IGF (IGFBP) a causa di una risposta anomala degli osteoblasti dell'osso subcondrale, che contribuisce alla sua sclerosi. Quest'ultima, a sua volta, può contribuire alla comparsa di microfratture della cartilagine propria e al danneggiamento della sua matrice.
In condizioni normali, questo danno viene riparato dalla sintesi e dal rilascio locale di IGF-1 e della proteina legante l'IGF, che stimolano la formazione della matrice extracellulare (ECM) della cartilagine articolare. Allo stesso tempo, il sistema GF promuove la crescita delle cellule ossee subcondrali e la formazione di matrice ossea. L'attività anabolica del sistema IGF è aumentata nell'osso subcondrale dei pazienti con osteoartrosi, mentre l'attivazione locale del sistema AP/plasmina (un regolatore locale del sistema IGF) nella cartilagine articolare ne provoca alterazioni locali. Negli osteoblasti in osteoartrosi, l'IGF-1 interrompe la regolazione dell'AP da parte della plasmina tramite un meccanismo di feedback positivo, quindi può inibire il rimodellamento del tessuto osseo, che in ultima analisi porta alla sclerosi subcondrale. Pertanto, nel tessuto osseo e cartilagineo, l'induzione locale di IGF-1 e proteasi porta, da un lato, al danno cartilagineo, dall'altro, all'ispessimento dell'osso subcondrale, quest'ultimo a sua volta contribuendo a ulteriore danno cartilagineo. Lo squilibrio tra il danno cartilagineo associato alla sclerosi subcondrale e le sue capacità riparative porta a progressive alterazioni della matrice extracellulare cartilaginea e allo sviluppo di osteoartrosi. Secondo gli autori, questa ipotesi spiega anche la lenta progressione della malattia.

