Esperto medico dell'articolo
Nuove pubblicazioni
Virus dell'immunodeficienza umana (HIV)
Ultima recensione: 04.07.2025

Tutti i contenuti di iLive sono revisionati o verificati da un punto di vista medico per garantire la massima precisione possibile.
Abbiamo linee guida rigorose in materia di sourcing e colleghiamo solo a siti di media affidabili, istituti di ricerca accademici e, ove possibile, studi rivisti dal punto di vista medico. Nota che i numeri tra parentesi ([1], [2], ecc.) Sono link cliccabili per questi studi.
Se ritieni che uno qualsiasi dei nostri contenuti sia impreciso, scaduto o comunque discutibile, selezionalo e premi Ctrl + Invio.
La sindrome da immunodeficienza acquisita (SSA) è stata identificata come malattia specifica nel 1981 negli Stati Uniti, quando diversi giovani hanno sviluppato gravi malattie causate da microrganismi non patogeni o debolmente patogeni per le persone sane. Uno studio sullo stato immunitario dei pazienti ha rivelato una forte diminuzione del numero di linfociti in generale e di cellule T helper in particolare. Questa condizione è stata chiamata AIDS (Sindrome da immunodeficienza acquisita). La modalità di infezione (contatto sessuale, tramite sangue e suoi preparati) indicava la natura infettiva della malattia.
L'agente eziologico dell'AIDS fu scoperto nel 1983 indipendentemente dal francese L. Montagnier, che lo chiamò LAV Lymphoadenopathy Associated Virus, poiché lo trovò in un paziente affetto da linfoadenopatia; e dall'americano R. Gallo, che lo chiamò HTLV-III (Human T-lymphotropic Virus III): in precedenza aveva scoperto i virus linfotropici I e II.
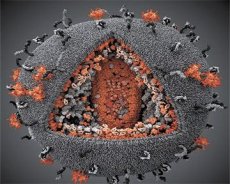
Un confronto tra le proprietà dei virus LAV e HTLV-III ne ha evidenziato l'identità, così, per evitare confusioni, nel 1986 il virus è stato denominato HIV (Human Immunodeficiency Virus, o HIV). L'HIV ha una forma sferica, con un diametro di 110 nm. L'involucro virale ha la forma di un poliedro, composto da 12 pentagoni e 20 esagoni. Al centro e agli angoli di ogni esagono si trova una molecola di proteina glicosilata gpl20 (il numero 120 indica il peso molecolare della proteina in kilodalton). Un totale di 72 molecole di gpl20 si trovano sulla superficie del virione sotto forma di peculiari punte, ciascuna delle quali è associata alla proteina intramembrana gp41. Queste proteine, insieme al doppio strato lipidico, formano il supercapside (membrana) del virione.
Le proteine gpl20 e gp41 si formano tagliando la proteina precursore di Env da una proteasi cellulare. La proteina gp41 forma lo "stelo" della proteina spike legandosi con il suo dominio citoplasmatico alla proteina di matrice p17MA, situata direttamente sotto l'envelope. Le molecole di p17 interagiscono durante la maturazione del virione per formare un icosaedro sottostante l'envelope.
Nella parte centrale del virione, la proteina p24 forma un capside a forma di cono. La parte ristretta del capside è connessa alla membrana del virione con la partecipazione della proteina rb. All'interno del capside sono presenti due molecole identiche di RNA genomico virale. Sono collegate tramite le loro estremità 5' alla proteina nucleocapsidica p7NC. Questa proteina è interessante perché presenta due residui amminoacidici (motivi) ricchi di cisteina e istidina e contenenti un atomo di zinco: sono chiamati "dita di zinco" perché catturano le molecole di RNA genomico per includerle nei virioni in formazione. Il capside contiene anche tre enzimi. La revertasi (RT), o complesso pol, include la trascrittasi inversa, la RNasi H e la DNA polimerasi DNA-dipendente. La revertasi è presente come eterodimero p66/p51. La proteasi (PR) - p10 - avvia e implementa il processo di maturazione del virione. Integrasi (IN) - p31, o endonucleasi, assicura l'inclusione del DNA provirale nel genoma della cellula ospite. Il capside contiene anche una molecola di RNA primer (tRNA113).
Il genoma a RNA nella cellula viene convertito in un genoma a DNA (DNA provirus) con l'aiuto della trascrittasi inversa, composto da 9283 coppie di nucleotidi. È delimitato a sinistra e a destra dalle cosiddette ripetizioni terminali lunghe, o LTR: S'-LTR a sinistra e 3'-LTR a destra. Le LTR contengono 638 coppie di nucleotidi ciascuna.
Il genoma dell'HIV è composto da 9 geni, alcuni dei quali si sovrappongono alle estremità (hanno diverse cornici di lettura) e hanno una struttura a esonintrone. Controllano la sintesi di 9 proteine strutturali e 6 proteine regolatrici.
L'importanza delle LTR per il genoma virale è che contengono i seguenti elementi regolatori che ne controllano il funzionamento:
- segnale di trascrizione (regione promotore);
- segnale di addizione poli-A;
- segnale di capping;
- segnale di integrazione;
- segnale di regolazione positiva (TAR per la proteina TAT);
- elemento regolatore negativo (NRE per la proteina NEF);
- un sito per l'attacco dell'RNA primer (tRNA™3) per la sintesi del DNA a filamento negativo all'estremità 3'; un segnale all'estremità 5' dell'LTR che funge da primer per la sintesi del DNA a filamento positivo.
Inoltre, LTR contiene elementi coinvolti nella regolazione dello splicing dell'mRNA e nel confezionamento delle molecole di vRNA nel capside (elemento Psi). Infine, durante la trascrizione del genoma, si formano due segnali negli mRNA lunghi per la proteina REV, che commutano la sintesi proteica: CAR - per le proteine regolatrici e CRS - per le proteine strutturali. Se la proteina REV si lega a CAR, vengono sintetizzate proteine strutturali; se è assente, vengono sintetizzate solo proteine regolatrici.
I seguenti geni regolatori e le loro proteine svolgono un ruolo particolarmente importante nella regolazione del funzionamento del genoma virale:
- Proteina TAT, che svolge un controllo positivo della replicazione virale e agisce attraverso la regione regolatrice TAR;
- Proteine NEV e VPU, che esercitano un controllo negativo della replicazione attraverso la regione NRE;
- Proteina REV, che svolge un controllo positivo-negativo. La proteina REV controlla il funzionamento dei geni gag, pol, env e svolge una regolazione negativa dello splicing.
Pertanto la replicazione dell'HIV è sottoposta a un triplo controllo: positivo, negativo e positivo-negativo.
La proteina VIF determina l'infettività del virus neosintetizzato. È associata alla proteina del capside p24 ed è presente nel virione in una quantità di 60 molecole. La proteina NEF è rappresentata nel virione da un piccolo numero di molecole (5-10), probabilmente associate all'envelope.
La proteina VPR inibisce il ciclo cellulare in fase G2, partecipa al trasporto dei complessi di preintegrazione nel nucleo cellulare, attiva alcuni geni virali e cellulari e aumenta l'efficienza della replicazione virale nei monociti e nei macrofagi. La posizione delle proteine VPR, TAT, REV e VPU nel virione non è stata ancora stabilita.
Oltre alle proprie proteine, la membrana del virione può contenere anche alcune proteine della cellula ospite. Le proteine VPU e VPR partecipano alla regolazione della riproduzione virale.
Varianti antigeniche del virus dell'immunodeficienza umana (HIV)
Il virus dell'immunodeficienza umana (HIV) è molto variabile. Anche dal corpo di un singolo paziente è possibile isolare ceppi virali che differiscono significativamente nelle proprietà antigeniche. Tale variabilità è facilitata dall'intensa distruzione delle cellule CD4+ e da una potente risposta anticorpale all'infezione da HIV. Una nuova forma di HIV, l'HIV-2, biologicamente simile all'HIV-1 ma immunologicamente diversa, è stata isolata da pazienti dell'Africa occidentale. L'omologia della struttura primaria dei genomi di questi virus è del 42%. Il provirus a DNA HIV-2 contiene 9671 bp e la sua LTR - 854 bp. L'HIV-2 è stato successivamente isolato in altre regioni del mondo. Non esiste immunità crociata tra HIV-1 e HIV-2. Sono note due forme principali di HIV-1: O (Outlier) e M (Major), quest'ultima suddivisa in 10 sottotipi (AJ). Otto sottotipi (AH) circolano in Russia.
 [ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
[ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
Il meccanismo di interazione dell'HIV con la cellula
Una volta penetrato nell'organismo, il virus attacca innanzitutto le cellule che contengono il recettore CD4 specifico per lui. Questo recettore è presente in grandi quantità nei T-helper, in quantità minori nei macrofagi e nei monociti, e i T-helper sono particolarmente sensibili al virus.
Il virus dell'immunodeficienza umana (HIV) riconosce i recettori CD4 tramite la sua proteina gpl20. Il processo di interazione dell'HIV con la cellula avviene secondo il seguente schema: adsorbimento mediato dal recettore -> fossetta rivestita -> vescicola rivestita -> lisosoma. In questo processo, la membrana del virione si fonde con la membrana del lisosoma e il nucleocapside, liberato dal supercapside, entra nel citoplasma; durante il percorso verso il nucleo, viene distrutto e l'RNA genomico e i componenti del core associati vengono rilasciati. Successivamente, la trascrittasi inversa sintetizza il filamento meno del DNA sull'RNA del virione, quindi la RNasi H distrugge l'RNA del virione e la DNA polimerasi virale sintetizza il filamento più del DNA. 5'-LTR e 3'-LTR si formano alle estremità del DNA provirus. Il provirus a DNA può rimanere nel nucleo per un certo periodo di tempo in forma inattiva, ma prima o poi viene integrato nel cromosoma della cellula bersaglio con l'aiuto della sua integrasi. In questo contesto, il provirus rimane inattivo finché il linfocita T in questione non viene attivato da antigeni microbici o da altre cellule immunocompetenti. L'attivazione della trascrizione del DNA cellulare è regolata da uno speciale fattore nucleare (NF-kB). Si tratta di una proteina legante il DNA e viene prodotta in grandi quantità durante l'attivazione e la proliferazione dei linfociti T e dei monociti. Questa proteina si lega a determinate sequenze di DNA cellulare e a sequenze LTR simili del provirus a DNA, inducendo la trascrizione sia del DNA cellulare che del provirus a DNA. Inducendo la trascrizione del provirus a DNA, determina la transizione del virus da uno stato inattivo a uno attivo e, di conseguenza, da un'infezione persistente a una produttiva. Il provirus può rimanere in stato inattivo per un tempo molto lungo. L'attivazione del virus è un momento critico nella sua interazione con la cellula.
Dal momento in cui il virus penetra nella cellula, inizia il periodo di infezione da HIV: lo stato di portatore del virus, che può durare 10 anni o più; e dal momento in cui il virus viene attivato, inizia la malattia: l'AIDS. Con l'aiuto dei suoi geni regolatori e dei loro prodotti, il virus inizia a riprodursi attivamente. La proteina TAT può aumentare il tasso di riproduzione del virus di 1000 volte. La trascrizione virale è complessa. Include la formazione di mRNA sia a lunghezza intera che subgenomica, lo splicing dell'mRNA e, successivamente, la sintesi di proteine strutturali e regolatrici.
La sintesi delle proteine strutturali avviene come segue. Innanzitutto, viene sintetizzata la poliproteina precursore Pr55Gag (una proteina con un peso molecolare di 55 kDa). Essa contiene 4 domini principali: matrice (MA), capside (CA), nucleocapside (NC) e il dominio rb, da cui, in seguito al taglio di Pr55Gag da parte della proteasi virale (viene autotagliata da un'altra proteina precursore, Gag-Pol), si formano rispettivamente le proteine strutturali p17, p24, p7 e rb. La formazione della poliproteina Pr55Gag è la condizione principale per la formazione delle particelle virali. È questa proteina che determina il programma di morfogenesi del virione. Include sequenzialmente le fasi di trasporto della poliproteina Gag alla membrana plasmatica, l'interazione con essa e le interazioni proteina-proteina durante la formazione della particella virale e la sua gemmazione. Pr55Gag è sintetizzato su poliribosomi liberi; Le molecole proteiche vengono trasportate verso la membrana, dove sono ancorate dalle loro regioni idrofobiche. Il dominio CA svolge il ruolo principale nel creare la conformazione nativa della proteina Gag. Il dominio NC assicura l'inclusione (con l'aiuto delle sue "dita di zinco") di 2 molecole di RNA genomico nella composizione della particella virale in formazione. La molecola poliproteica inizialmente dimerizza a causa dell'interazione dei domini della matrice. Successivamente, i dimeri si combinano in complessi esamerici (di 6 unità) a seguito dell'interazione dei domini CA e NC. Infine, gli esameri, unendosi alle loro superfici laterali, formano virioni sferici immaturi, al cui interno è contenuto l'RNA virale genomico, catturato dal dominio NC.
Un'altra proteina precursore, Prl60Gag-Pol (una proteina con un peso molecolare di 160 kDa), viene sintetizzata a seguito di un frameshift da parte del ribosoma durante la traduzione dell'estremità 3' del gene gag nella regione situata immediatamente a monte della regione che codifica per la proteina rb. Questa poliproteina Gag-Pol contiene una sequenza proteica Gag incompleta (1-423 amminoacidi) e sequenze Pol che includono i domini PR, RT e IN. Le molecole di poliproteina Gag-Pol vengono sintetizzate anche sui poliribosomi liberi e vengono trasportate alla membrana plasmatica. La poliproteina Prl60Gagpol contiene tutti i siti di interazione intermolecolare e i siti di legame alla membrana caratteristici della poliproteina Gag. Pertanto, le molecole di poliproteina Gag-Pol si fondono con la membrana e, insieme alle molecole di Gag, vengono incluse nei virioni in formazione, determinando la comparsa di proteasi attiva e l'inizio del processo di maturazione del virione. La proteasi dell'HIV-1 è altamente attiva solo sotto forma di dimero, pertanto, per la sua autoescissione da Prl60Gag-Pol, è necessaria la dimerizzazione di queste molecole. La maturazione del virione consiste nel fatto che la proteasi attiva rilasciata taglia prl60Gag-Pol e Gag55 nei siti da essa riconosciuti; si formano le proteine p17, p24, p7, p6, revertasi e integrasi, e si verifica la loro associazione nella struttura virale.
La proteina Env viene sintetizzata sui ribosomi associati alle membrane del reticolo endoplasmatico, quindi viene glicosilata, scissa da una proteasi cellulare in gp120 e gp41 e trasportata sulla superficie cellulare. In questo caso, gp41 penetra la membrana e si lega ai domini di matrice della molecola proteica Gag associata alla superficie interna della membrana. Questa connessione è preservata nel virione maturo.
Pertanto, l'assemblaggio delle particelle virali consiste nell'aggregazione delle proteine precursori e delle molecole di RNA associate sulla membrana plasmatica della cellula ospite, nella formazione di virioni immaturi e nel loro rilascio per gemmazione dalla superficie cellulare. Durante la gemmazione, il virione si circonda di una membrana cellulare in cui sono immerse le molecole gp41 e gp120. Durante la gemmazione o, eventualmente, dopo il rilascio dei virioni, avviene la loro maturazione, che viene effettuata con l'aiuto di una proteasi virale e consiste nel taglio proteolitico delle proteine precursori Pr55Gag e Prl60Gag-Pol in proteine del virus maturo e nella loro associazione in determinati complessi strutturali. Il ruolo principale nei processi di morfogenesi virale è svolto dalla poliproteina precursore Pr55Gag, che organizza e assembla il virione immaturo; il processo di sua maturazione è completato da una proteasi virale specifica.
Cause di immunodeficienza
Una delle principali cause di immunodeficienza nell'infezione da HIV è la morte di massa dei linfociti T helper. Questa si verifica a seguito dei seguenti eventi. In primo luogo, i linfociti T helper infettati dal virus muoiono per apoptosi. Si ritiene che nei pazienti affetti da AIDS la replicazione virale, l'apoptosi e la diminuzione del numero di linfociti T helper siano interconnessi. In secondo luogo, i linfociti T killer riconoscono e distruggono i linfociti T infettati dal virus o portatori di molecole gpl20 adsorbite, così come i linfociti T helper infettati e non infettati dal virus, che formano sincizi costituiti da diverse decine di cellule (alcune delle quali muoiono a causa della riproduzione dei virus al loro interno). A seguito della distruzione di un gran numero di cellule T helper, si verifica una diminuzione dell'espressione dei recettori di membrana nei linfociti B per l'interleuchina-2, la sintesi di varie interleuchine (fattori di crescita e differenziazione dei linfociti B - IL-4, IL-5, IL-6, ecc.) viene interrotta, con conseguente compromissione della funzionalità del sistema T-killer. L'attività del sistema del complemento e dei macrofagi viene soppressa. Macrofagi e monociti infettati dal virus non muoiono per lungo tempo, ma non sono in grado di rimuovere il virus dall'organismo. Infine, grazie alla somiglianza strutturale e antigenica di gpl20 con i recettori di alcune cellule epiteliali dell'organismo (inclusi i recettori del trofoblasto che mediano la trasmissione dell'HIV tramite trapianto), vengono sintetizzati anticorpi antirecettore ad ampio spettro d'azione. Tali anticorpi sono in grado di bloccare vari recettori cellulari e complicare il decorso della malattia con disturbi autoimmuni. La conseguenza dell'infezione da HIV è la sconfitta di tutti i principali anelli del sistema immunitario. Questi pazienti diventano indifesi contro un'ampia varietà di microrganismi. Ciò porta allo sviluppo di infezioni opportunistiche e tumori. Per i pazienti con infezione da HIV, il rischio di sviluppare almeno tre tipi di cancro è aumentato: sarcoma di Kaposi; carcinoma (incluso il cancro della pelle); linfoma a cellule B, che si verifica a causa della trasformazione maligna dei linfociti B. Tuttavia, l'HIV non è solo linfocitotropico, ma anche neurotropico. Penetra nelle cellule del sistema nervoso centrale (astrociti) sia per endocitosi mediata da recettori sia per fagocitosi dei linfoblasti infettati dal virus da parte degli astrociti. Quando il virus interagisce con gli astrociti, si formano anche simplasti, che facilitano la diffusione del patogeno attraverso i canali intercellulari. Il virus può persistere a lungo nei macrofagi e nei monociti, che fungono quindi da serbatoio e distributore del virus nell'organismo, essendo in grado di penetrare in tutti i tessuti. I macrofagi infetti svolgono un ruolo fondamentale nell'introduzione dell'HIV nel sistema nervoso centrale e nel suo danno. Nel 10% dei pazienti, le sindromi cliniche primarie sono associate a danni al sistema nervoso centrale e si manifestano come demenza. Pertanto, le persone infette da HIV sono caratterizzate da 3 gruppi di malattie: infezioni opportunistiche,malattie tumorali e danni al sistema nervoso centrale.
Epidemiologia dell'infezione da HIV
La fonte dell'infezione da HIV è solo una persona: una persona malata o un portatore del virus. Il virus dell'immunodeficienza umana (HIV) è presente nel sangue, nello sperma, nel liquido cervicale; nelle madri che allattano, nel latte materno. L'infezione avviene per via sessuale, attraverso il sangue e i suoi preparati, nonché da madre a figlio prima, durante e dopo il parto. Non sono noti casi di infezione del virus attraverso alimenti, bevande e punture di insetti.
La tossicodipendenza contribuisce alla diffusione dell'AIDS. L'incidenza dell'HIV aumenta ogni anno. Secondo l'OMS, dal 1980 al 2000, 58 milioni di persone hanno contratto l'infezione da HIV. Solo nel 2000, 5,3 milioni di persone sono state contagiate in tutto il mondo e 3 milioni sono morte di AIDS. Al 1° gennaio 2004, in Russia si registravano 264.000 persone infette da HIV. Metà delle persone infette da HIV muore entro 11-12 anni dal momento dell'infezione. All'inizio del 2004, su 100.000 cittadini russi, circa 180 vivevano con una diagnosi di "infezione da HIV". Si prevede che, con questo livello di morbilità, il numero totale di persone infette da HIV in Russia entro il 2012 sarà di 2,5-3 milioni di persone. La complessità della lotta contro l'infezione da HIV dipende da una serie di ragioni: in primo luogo, non esistono metodi efficaci per il trattamento e la prevenzione specifica; In secondo luogo, il periodo di incubazione dell'infezione da HIV può superare i 10 anni. La sua durata dipende dal momento di attivazione del linfocita T e del provirus a DNA contenuto nel suo cromosoma. Non è ancora chiaro se tutti coloro che sono infettati dal virus siano destinati all'AIDS o se sia possibile una trasmissione a lungo termine del virus senza malattia (il che sembra improbabile). Infine, esistono diversi virus dell'immunodeficienza umana (HIV-1, HIV-2), le cui differenze antigeniche impediscono la formazione di immunità crociata. La scoperta del virus dell'immunodeficienza delle scimmie (SIV) ha fatto luce sulla questione dell'origine dell'HIV. Il SIV è simile all'HIV nell'organizzazione del genoma, ma differisce significativamente nella sequenza nucleotidica. L'HIV-2 occupa una posizione intermedia tra HIV-1 e SIV nelle sue proprietà sierologiche ed è più vicino al SIV nella sua sequenza nucleotidica. A questo proposito, V.M. Zhdanov ha suggerito che i virus HIV-1, HIV-2 e SIV abbiano avuto origine da un antenato comune. È possibile, secondo R. Gallo, che uno degli SIV sia in qualche modo entrato nel corpo umano, dove ha subito una serie di mutazioni, dando origine all'HIV-1, all'HIV-2 e alle sue altre forme.
Sintomi dell'infezione da HIV
Il virus dell'immunodeficienza umana (HIV) presenta alcune caratteristiche che determinano in larga misura la patogenesi della malattia. Il virus ha un tasso di riproduzione molto elevato, determinato dai suoi elementi regolatori (fino a 5.000 virioni vengono sintetizzati in 5 minuti nella fase attiva). Grazie alla presenza della proteina di fusione (gp41), il virus induce la formazione di estese strutture sinciziali dovute alla fusione di cellule T helper infette e non infette, che ne determina la morte in massa. Le molecole di proteina gpl20 formate in grandi quantità circolano liberamente nel sangue e si legano ai recettori delle cellule T helper non infette, venendo quindi riconosciute e distrutte anche dalle cellule T killer. Il virus può diffondersi attraverso i canali intercellulari da una cellula all'altra, diventando in tal caso difficilmente accessibile agli anticorpi.
Criteri clinici per l'infezione da HIV
Negli adulti, l'infezione da HIV viene diagnosticata quando si presentano almeno due sintomi gravi in combinazione con almeno un sintomo minore e in assenza di altre cause note di immunodeficienza (cancro, immunodeficienza congenita, grave denutrizione, ecc.). I sintomi gravi includono:
- perdita di peso pari o superiore al 10%;
- una condizione febbrile prolungata, intermittente o costante;
- diarrea cronica.
Sintomi minori: tosse persistente, dermatite generalizzata, herpes zoster ricorrente, candidosi orale e faringea, herpes simplex cronico, linfoadenopatia generalizzata. La diagnosi di AIDS viene posta solo in presenza di sarcoma di Kaposi, meningite criptococcica, polmonite da pneumocystis. Il quadro clinico della malattia è influenzato dalle infezioni opportunistiche concomitanti.
Metodi di coltura del virus dell'immunodeficienza umana (HIV)
HIV-1 e HIV-2 possono essere coltivati in cellule di un solo clone di linfociti TCV4, H9, ottenuto da linfociti TCV4 leucemici. Anche le colture monostrato di cellule astrocitarie, in cui HIV-1 si riproduce bene, possono essere utilizzate a questo scopo. Gli scimpanzé sono animali suscettibili all'HIV-1.
La resistenza del virus nell'ambiente esterno è bassa. Muore sotto l'effetto della luce solare e dei raggi UV, viene distrutto a 80 °C entro 30 minuti, mentre se trattato con disinfettanti comunemente usati, entro 20-30 minuti. Per disinfettare materiali contenenti virus, è necessario utilizzare disinfettanti micobattericidi, poiché sono efficaci contro i microrganismi più resistenti.
Diagnosi di laboratorio dell'infezione da HIV
Il metodo principale per diagnosticare la portabilità del virus e l'infezione da HIV è l'immunoanalisi enzimatica. Tuttavia, a causa della somiglianza strutturale e antigenica di gpl20 con i recettori di alcune cellule umane, inclusi i recettori che trasportano le immunoglobuline attraverso le cellule epiteliali delle mucose, nell'organismo possono comparire anticorpi correlati agli anticorpi contro gpl20. In questo caso, si potrebbero verificare risultati ELISA falsi positivi. Pertanto, tutti i sieri dei soggetti che reagiscono positivamente vengono sottoposti ad analisi aggiuntive utilizzando il metodo dell'immunoblotting, o Western Blotting. Questo metodo si basa sull'identificazione degli anticorpi in studio dopo la loro separazione elettroforetica e la successiva analisi con anticorpi anti-specie marcati. Il metodo virologico è raramente utilizzato a causa della complessità della coltura del virus. Il clone linfocitario H9 viene utilizzato per ottenere antigeni virali, i componenti necessari dei sistemi di test diagnostici. Il metodo CPR consente di rilevare il virus in una fase precoce della viremia.
Trattamento dell'infezione da HIV
È necessario trovare o sintetizzare farmaci che sopprimano efficacemente l'attività della trascrittasi inversa (revertasi) o della proteasi virale. Questi farmaci impedirebbero la formazione del DNA provirus e (o) inibirebbero la riproduzione intracellulare del virus. La moderna strategia per il trattamento dei pazienti con infezione da HIV si basa sul principio dell'uso combinato di farmaci che inibiscono la proteasi virale (uno dei farmaci) e la reverseasi (2 farmaci diversi) - terapia combinata (tripla). In Russia, per il trattamento dei pazienti con infezione da HIV, si raccomanda l'uso combinato di 2 farmaci nazionali: fosfazide e crixivan, che sopprimono specificamente la riproduzione dell'HIV nelle fasi precoci e tardive della riproduzione, in particolare con ridotta attività dell'azidotimidina.
Il problema della profilassi specifica risiede nella necessità di creare un vaccino che garantisca la formazione di un'immunità cellulo-mediata efficace basata sui linfociti citotossici virus-specifici, senza alcuna significativa produzione di anticorpi. Tale immunità è fornita dai Thl helper. È possibile che gli anticorpi, compresi quelli neutralizzanti il virus, non solo siano inefficaci nel sopprimere l'infezione da HIV, ma che a livelli elevati sopprimano l'immunità cellulo-mediata. Pertanto, un vaccino anti-HIV deve soddisfare, innanzitutto, due requisiti principali: a) essere assolutamente sicuro e b) stimolare l'attività dei linfociti T-citotossici. È in fase di studio l'efficacia di diverse varianti di vaccino ottenute da virus uccisi (inattivati) e da singoli antigeni con elevate proprietà protettive. Tali antigeni possono essere isolati dai virioni stessi o sintetizzati chimicamente. È stato proposto un vaccino creato con metodi di ingegneria genetica. Si tratta di un virus vaccinico ricombinante che trasporta geni dell'HIV responsabili della sintesi di antigeni con forti proprietà immunogeniche. La questione dell'efficacia di questi vaccini richiede molto tempo a causa del lungo periodo di incubazione dell'infezione da HIV e dell'elevata variabilità del patogeno. La creazione di un vaccino altamente efficace contro l'HIV è un problema fondamentale e urgente.

