Esperto medico dell'articolo
Nuove pubblicazioni
Rabbia nei bambini
Ultima recensione: 04.07.2025

Tutti i contenuti di iLive sono revisionati o verificati da un punto di vista medico per garantire la massima precisione possibile.
Abbiamo linee guida rigorose in materia di sourcing e colleghiamo solo a siti di media affidabili, istituti di ricerca accademici e, ove possibile, studi rivisti dal punto di vista medico. Nota che i numeri tra parentesi ([1], [2], ecc.) Sono link cliccabili per questi studi.
Se ritieni che uno qualsiasi dei nostri contenuti sia impreciso, scaduto o comunque discutibile, selezionalo e premi Ctrl + Invio.
La rabbia, o idrofobia, è una malattia virale acuta trasmessa attraverso il morso di un animale infetto, che provoca danni al sistema nervoso e lo sviluppo di una grave encefalite con esito fatale.
Epidemiologia
Flagello della salute pubblica fin dall'antichità, il virus della rabbia causa attualmente circa 59.000 decessi umani ogni anno, quasi tutti trasmessi da morsi di cane. Ciò ha un impatto economico significativo sui paesi in via di sviluppo, in particolare in Africa e Asia, che possono sopportare meno perdite di questo tipo. Tuttavia, nonostante un tasso di mortalità prossimo al 100%, la rabbia canina è una malattia completamente prevenibile, e gli esempi storici di eradicazione della rabbia canina nei paesi sviluppati lo attestano. [ 1 ]
Le cause rabbia
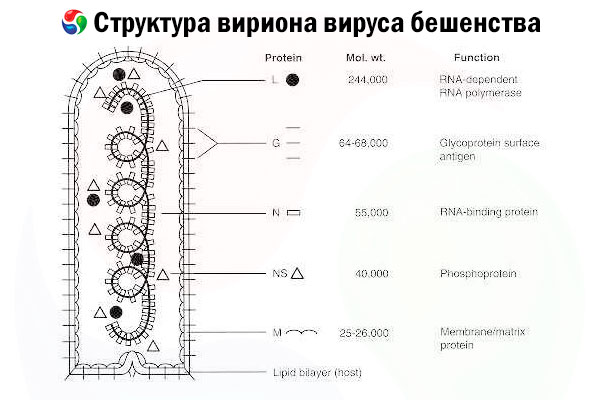
L'agente eziologico è il virus della rabbia (RV), un virus a RNA a filamento negativo della famiglia dei rhabdovirus, dalle dimensioni di circa 60 nm × 180 nm.
È costituito da un nucleo proteico interno, o nucleocapside, contenente acido nucleico, e da una membrana esterna, un doppio strato lipidico ricoperto da glicoproteine transmembrana. Ha una struttura genomica modulare relativamente semplice e codifica cinque proteine strutturali:
- RNA polimerasi RNA-dipendente (L),
- nucleoproteina (N),
- proteina fosforilata (P),
- proteina della matrice (M) e
- glicoproteina della superficie esterna (G).
Le proteine N, P e L, insieme all'RNA genomico, formano il complesso ribonucleoproteico. G è l'unico antigene RV in grado di indurre la produzione di anticorpi neutralizzanti RV, che rappresentano i principali effettori immunitari contro l'infezione letale da RV. D'altra parte, è stato dimostrato che il complesso ribonucleoproteico è il principale antigene RV in grado di indurre la produzione di cellule T CD4+, che possono aumentare la produzione di anticorpi neutralizzanti RV attraverso il riconoscimento intrastrutturale dell'antigene.[ 2 ] Il complesso ribonucleoproteico può svolgere un ruolo importante nello sviluppo della memoria immunologica e dell'immunità a lungo termine.[ 3 ]
Classificazione e tipi di antigeni
Il genere Lyssavirus comprende il virus della rabbia e virus della rabbia antigenicamente e geneticamente correlati: i virus del pipistrello Lagos, Mokola e Duvenhage, nonché due presunti sottotipi di lyssavirus del pipistrello europeo. Studi di protezione crociata indicano che gli animali immunizzati con i vaccini antirabbici tradizionali potrebbero non essere completamente protetti in caso di infezione con altri lyssavirus.
I virus della rabbia possono essere classificati come fissi (adattati tramite passaggio in animali o colture cellulari) o selvatici (tipo selvatico). L'uso di anticorpi monoclonali e del sequenziamento genetico per differenziare i virus della rabbia selvatica ha contribuito a identificare varianti virali provenienti dai principali serbatoi di ospiti in tutto il mondo e a suggerire probabili fonti di esposizione umana in assenza di una storia di morso di animale definitivo nel caso di un paziente.[ 8 ]
Patogenesi
Il principale serbatoio e fonte di infezione tra gli animali selvatici sono lupi, volpi, sciacalli e pipistrelli, mentre tra gli animali domestici (raramente cani e gatti) si trovano cavalli, bovini, maiali, ratti, ecc. La trasmissione dell'infezione da persona a persona, sebbene possibile, è estremamente rara. Si tratta di una tipica infezione zoonotica. L'uomo contrae la rabbia principalmente tramite il contatto con i cani.
Dopo che un essere umano viene morso da un animale malato, il virus si moltiplica nel tessuto muscolare nel sito del morso e, una volta raggiunte le estremità dei nervi periferici sensoriali, si diffonde centripetamente, raggiungendo i motoneuroni. Il tempo necessario al virus per spostarsi e colpire il cervello dipende dalla sede del morso. In caso di morsi gravi alla testa e al viso, il virus può raggiungere il sistema nervoso centrale in 15-20 giorni, mentre in caso di lesioni minori alla pelle del tronco e degli arti e, di conseguenza, di una piccola dose del patogeno, il processo di spostamento del virus al sistema nervoso centrale può essere ritardato di diversi mesi o addirittura fino a 1-1,5 anni. Una volta raggiunto il sistema nervoso centrale, il virus si fissa nei tessuti dell'encefalo e del midollo spinale, principalmente nei neuroni del midollo allungato, del corno di Ammone e della base dell'encefalo. Nel midollo spinale, le corna posteriori sono le più colpite. Dal sistema nervoso centrale, il virus, muovendosi centrifugamente lungo i tronchi nervosi, raggiunge le ghiandole salivari, dove si moltiplica e viene espulso con la saliva.
Concetti nella patogenesi della rabbia
Il virus della rabbia (RV) ha un'ampia gamma di ospiti e può infettare quasi tutti i mammiferi. Sebbene siano state segnalate diverse vie di trasmissione del virus, l'infezione naturale avviene più comunemente tramite morso. Oltre ai morsi, il consumo di carcasse infette da RV può favorire l'infezione da virus della rabbia nelle volpi artiche e il contatto del virus della rabbia con le mucose è stato identificato come un'altra possibile via di trasmissione.[ 9 ] In alcune circostanze insolite, come il rilascio accidentale di RV sotto forma di aerosol in un laboratorio o in grotte abitate da un gran numero di pipistrelli,[ 10 ] può verificarsi la trasmissione tramite aerosol.
Non è ancora chiaro se il virus della ricaptazione della trombosi venosa (RV) di strada e i ceppi di RV adattati al topo o adattati alla coltura tissutale si replichino nel sito di inoculazione prima di entrare nel SNC. Mentre l'infezione intramuscolare sperimentale di criceti o procioni giovani con RV di strada ha rivelato la replicazione del RV nelle cellule muscolari striate prima che il virus invadesse gli assoni dei motoneuroni attraverso le giunzioni neuromuscolari,[ 11 ],[ 12 ] l'infezione intramuscolare di topi con RV CVS-24 adattato al topo ha mostrato che il RV migra direttamente al SNC senza una precedente replicazione nel sito di inoculazione.[ 13 ] Una volta nei terminali degli assoni amielinici, il RV viene trasportato retrogradamente al corpo cellulare.
Recenti scoperte suggeriscono che il trasporto vescicolare assonale possa rappresentare una strategia chiave per il movimento a lunga distanza del virione negli assoni.[ 14 ] È stato stimato che RV migri all'interno degli assoni a una velocità di 3 mm/h.[ 15 ] L'infezione si diffonde quindi attraverso una catena di neuroni collegati da giunzioni sinaptiche. Tuttavia, l'esatto meccanismo che promuove la diffusione trans-sinaptica è ancora sconosciuto. Dopo aver infettato il cervello, il virus si diffonde centrifugamente al sistema nervoso periferico e autonomo in molti organi periferici.[ 16 ] Nell'ultima fase del ciclo infettivo, RV migra verso le ghiandole salivari; dopo la replicazione nelle cellule acinose mucogeniche, viene rilasciato nella saliva ed è pronto per la trasmissione al successivo ospite.[ 17 ]
Per quanto riguarda la patologia indotta dal virus della rabbia, la morte cellulare apoptotica è stata proposta come potenziale meccanismo patogeno in modelli sperimentali di rabbia di topi infettati da un ceppo fisso di RV.[ 18 ] Un meccanismo patogeno che può contribuire alla profonda disfunzione del SNC caratteristica della rabbia potrebbe essere la compromissione della funzione neuronale. È stato dimostrato che l'espressione genica è marcatamente ridotta nei neuroni infettati da RV, con conseguente soppressione generale della sintesi proteica,[ 19 ] e diversi studi hanno mostrato una neurotrasmissione compromessa a seguito dell'infezione da RV. Jiang ha dimostrato che il legame di un antagonista del recettore dell'acetilcolina agli omogenati di cervello di ratto infetto era ridotto rispetto ai controlli.[ 20 ] Nel cervello di ratto infettato da RV sono stati osservati anche un rilascio e un legame compromessi della serotonina, un neurotrasmettitore coinvolto nel controllo del ciclo del sonno, della percezione del dolore e del comportamento.[ 21 ], [ 22 ] Oltre a influenzare la neurotrasmissione, l'infezione del ventricolo destro può anche influenzare i canali ionici. Le cellule di neuroblastoma del topo infette mostrano una ridotta espressione funzionale dei canali del sodio voltaggio-dipendenti, che può prevenire i potenziali d'azione e portare infine a un deterioramento funzionale. [ 23 ]
Oltre all'assenza di gravi lesioni patologiche nel SNC, la maggior parte dei casi di rabbia umana non provoca una risposta immunitaria entro 7-10 giorni dall'insorgenza dei segni clinici. Queste profonde differenze tra la patogenesi della rabbia e quella della maggior parte delle altre infezioni virali o batteriche del SNC sono ulteriormente supportate dal fatto che l'immunosoppressione è inefficace o dannosa per l'esito della rabbia.[ 24 ] Il basso livello di risposta immunitaria spesso osservato nelle vittime di rabbia è sconcertante perché non può essere spiegato dalla scarsa immunogenicità degli antigeni del RV. Infatti, il RV G e la proteina del nucleocapside sono potenti antigeni delle cellule B e T quando somministrati per via parenterale. [ 25 ] Una possibile spiegazione per il basso grado di risposta immunitaria contro il RV negli esseri umani o negli animali con rabbia potrebbe essere che l'infezione del SNC da RV causa immunosoppressione, [ 26 ] ed è stato proposto che il RV utilizzi una strategia sovversiva che include la prevenzione dell'apoptosi e la distruzione delle cellule T invasori. [ 27 ]
I ceppi di RV attenuati che sono stati adattati a cellule non neuronali differiscono significativamente dai ceppi di RV patogeni di strada nella loro neuroinvasività, che si riferisce alla loro capacità di invadere il SNC da siti periferici. A questo proposito, i ceppi di RV adattati a colture tissutali non hanno o hanno solo una capacità limitata di invadere il SNC da siti periferici, mentre i ceppi di RV di strada o i ceppi di RV adattati al topo come CVS-24 sono altamente invasivi.[ 28 ] I fattori chiave coinvolti nella neuroinvasione del RV includono l'assorbimento virale, il trasporto assonale, la diffusione trans-sinaptica e il tasso di replicazione virale.
Fino a poco tempo fa, la nostra conoscenza della patogenesi del virus della rabbia (RV) era limitata e si basava principalmente su studi descrittivi di ceppi di RV di strada o su infezioni sperimentali con ceppi attenuati adattati in laboratorio. L'avvento della genetica inversa ci ha permesso di identificare gli elementi virali che determinano il fenotipo patogeno del RV e di comprendere meglio i meccanismi coinvolti nella patogenesi della rabbia.
Identificazione degli elementi virali che controllano l'acquisizione, la diffusione e la replicazione del virus della rabbia
- Elementi virali coinvolti nella cattura del virus
L'infezione da RV inizia con l'adesione del virus a un presunto recettore cellulare. Sebbene diverse molecole di superficie della membrana siano state proposte come recettori RV, tra cui il recettore nicotinico dell'acetilcolina,[ 29 ] la molecola di adesione delle cellule neurali[ 30 ] e il recettore neurotrofico a bassa affinità p75 NTR,[ 31 ] non è ancora chiaro se queste molecole svolgano effettivamente un ruolo nel ciclo vitale del virus della rabbia. In questo contesto, è stato recentemente dimostrato che l'interazione RV G–p75 NTR non è necessaria per l'infezione da RV dei neuroni primari.[ 32 ] Dopo il legame al recettore, RV viene internalizzato tramite endocitosi adsorbente o mediata dal recettore.[ 33 ] L'ambiente a basso pH all'interno del compartimento endosomiale induce quindi cambiamenti conformazionali in RV G che innescano la fusione della membrana virale con la membrana endosomiale, rilasciando così l'RNP nel citoplasma. [ 34 ] Per i virus, RV G svolge un ruolo critico nell'assorbimento virale, molto probabilmente attraverso interazioni con presunti recettori cellulari che facilitano l'assorbimento rapido. A questo proposito, è stato dimostrato che la patogenicità dei ceppi di RV adattati alla coltura tissutale (ad esempio, ERA, HEP e CVS-11) è correlata alla presenza di un determinante situato nel sito antigenico III della proteina G. [ 35 ] Una mutazione Arg → Gln in posizione 333 in questo sito antigenico della proteina ERA G ha comportato un ritardo sette volte maggiore nell'internalizzazione della variante RV Gln333 rispetto alla variante di tipo selvatico. La mutazione Asn194→Lys194 in RV G, che spiega la ricomparsa del fenotipo patogeno, è stata associata a una significativa diminuzione del tempo di internalizzazione.[ 36 ] Inoltre, gli esperimenti con RV chimerici hanno mostrato che il tempo richiesto per l'internalizzazione dei virioni RV era significativamente aumentato e la patogenicità era fortemente ridotta a seguito della sostituzione del gene G del ceppo RV SB altamente patogeno, derivato da un clone di cDNA del ceppo RV-18 associato al pipistrello derivato dall'argento,[ 37 ] con quello del ceppo SN altamente attenuato, isolato da un clone di cDNA del ceppo vaccinale RV SAD B19.[ 38 ] Insieme, questi dati supportano l'idea che la cinetica dell'assorbimento del virus, che è una funzione di RV G, sia un fattore determinante della patogenicità di RV.
- Elementi virali coinvolti nella diffusione e trasmissione dei virus
Una proprietà unica del virus della rabbia è la sua capacità di diffondersi da una cellula all'altra. L'osservazione che la variante Gln333 ERA perde l'attività di fusione cellula-cellula dipendente dal pH in vitro [ 39 ] e mostra una capacità notevolmente ridotta di diffondersi da una cellula all'altra [ 40 ] suggerisce che RV G svolge anche un ruolo chiave nella diffusione da cellula a cellula e quindi nella trasmissione del virus, probabilmente attraverso la sua attività fusiogenica. Questa possibilità è ulteriormente supportata dalla scoperta che il tasso di diffusione del revertante RV patogeno SPBNGAK è quasi il doppio di quello determinato per la variante SPBNGA non patogena. È interessante notare che la mutazione Asn 194 → Lys 194 in G SPBNGAK ha causato uno spostamento della soglia di pH per la fusione della membrana a un pH più elevato, supportando l'ipotesi che una soglia di pH più elevata per la fusione della membrana sia associata a una maggiore diffusione del virus. [ 41 ]
Studi sugli indicatori transneuronali dell'infezione da RV nei ratti [ 42 ] e nelle scimmie rhesus [ 43 ] hanno dimostrato che il virus della rabbia migra esclusivamente in direzione retrograda negli assoni. Sebbene diverse proteine RV siano coinvolte nei meccanismi di trasporto neuronale, RV G sembra svolgere un ruolo predominante nella diffusione transneuronale dell'infezione da RV. Ad esempio, mentre l'infezione periferica con il virus dell'anemia infettiva equina (EIAV) pseudotipizzato con RV G provoca il trasferimento virale al midollo spinale, lo stesso EIAV pseudotipizzato con il virus della stomatite vescicolare G non è riuscito a entrare nel sistema nervoso. [ 44 ] Inoltre, la diffusione virale del mutante ERA G Arg 333 → Gln 333 nel SNC è risultata fortemente ridotta rispetto al mutante di tipo selvatico, suggerendo ulteriormente una funzione di RV G intatto nella diffusione trans-sinaptica. Tuttavia, la prova più convincente di un ruolo importante di RV G nel trasporto trans-sinaptico proviene dall'infezione intracranica di topi con un virus RV ricombinante G-deficiente, che ha mostrato che l'infezione è rimasta limitata ai neuroni nel sito di inoculazione senza alcuna prova di diffusione ai neuroni secondari.[ 45 ] Tuttavia, è probabile che oltre a RV G, anche RV M svolga un ruolo nella diffusione del virus e quindi nel trasporto trans-sinaptico. A questo proposito, è stato dimostrato che la diffusione della variante chimerica RV SN-BMBG, che contiene sia M che G dall'SB altamente patogeno, era significativamente maggiore della diffusione della variante chimerica SN-BG o SN-BM, che contengono rispettivamente G e M dall'SB, suggerendo che l'interazione ottimale di M con G può svolgere un ruolo importante nella diffusione del virus da cellula a cellula. [ 46 ] Poiché RV M supporta la gemmazione del virus, [ 47 ] è probabile che la diffusione più efficiente della variante chimerica RV SN-BMBG sia dovuta alla gemmazione ottimale del virus sulla membrana postsinaptica.
Studi recenti hanno dimostrato che l'interazione tra RV P e la catena leggera della dineina collega l'RNP di RV al sistema di trasporto della cellula ospite, facilitando così il trasporto assonale retrogrado del virus.[ 48 ],[ 49 ] Tuttavia, l'infezione periferica di topi adulti ha mostrato che l'eliminazione del dominio di legame LC8 di RV P non impedisce l'ingresso del virus nel SNC, suggerendo che la proteina RV non è direttamente coinvolta nella diffusione assonale retrograda di RV.[ 50 ]
- Elementi virali che controllano la replicazione virale
A differenza di molti altri virus, come il virus dell'influenza, la patogenicità del rhabdovirus è inversamente proporzionale al tasso di sintesi dell'RNA virale e alla produzione di particelle virali infettive. Il confronto tra i livelli di mRNA virale e di RNA genomico prodotti da diversi virus chimerici suggerisce che la trascrizione e la replicazione dell'RNA virale siano regolate da molteplici fattori, tra cui il recettore M del rhabdovirus (RV), che è stato identificato come un fattore trans-agente che media il passaggio dagli elevati livelli iniziali di sintesi di mRNA alla sintesi di RNA genomico.[ 51 ] Inoltre, il recettore M di tutti i rhabdovirus è in grado di inibire l'espressione genica virale legandosi al nucleotide reticolato (RNP), con conseguente formazione di una struttura altamente condensata simile a uno scheletro che non è in grado di supportare la sintesi di RNA.
Per identificare altri elementi virali che controllano la patogenicità regolando la replicazione virale, le sequenze terminali 5' del ceppo SB altamente patogeno sono state sostituite gradualmente con sequenze del ceppo vaccinale SN altamente attenuato, dando origine ai virus ricombinanti SB2 (sequenza terminale [TS] + L), SB3 (TS + L + pseudogene [Ψ]), SB4 (TS + L + Ψ + G) e SB5 (TS + L + Ψ + G + M). L'infezione intramuscolare con i virus parentali SB e SN e i virus ricombinanti chimerici SB2, SB3, SB4 e SB5 ha provocato i più alti tassi di mortalità nei topi infettati da SB e nessuna morbilità o mortalità nei topi infettati da SN. La sostituzione di TS, L e SB con i corrispondenti elementi di SN ha determinato una modesta riduzione della morbilità e della mortalità, mentre un ulteriore scambio di G o G più M ha ridotto fortemente o completamente abolito la patogenicità virale.
La caratterizzazione fenotipica di questi RV wild-type e chimerici in coltura tissutale ha rivelato che la patogenicità di un dato RV è inversamente correlata alla sua capacità di replicarsi nelle cellule neuronali. Sebbene SB si replicasse a livelli quasi 1000 volte inferiori a SN e la sostituzione di TS, L e in SB con livelli di SN avesse scarso effetto sulla cinetica di crescita virale, l'ulteriore sostituzione di G o G più M di SB con i corrispondenti geni SN ha portato a un aumento di 1 log nella produzione virale, suggerendo che la cinetica di replicazione dell'RNA virale e la produzione di particelle virali siano ampiamente controllate dalla proteina G di RV. Questa conclusione è supportata da dati ottenuti con varianti G di RV che differiscono per un amminoacido nelle loro proteine G. La variante patogena del virus della rabbia SPBNGAK 194 ha prodotto un titolo virale nelle cellule NA che era 1 log inferiore a quello prodotto dalla variante non patogena SPBNGAN 194, e l'analisi PCR in tempo reale ha mostrato che i tassi di trascrizione e replicazione dell'RNA virale nelle cellule NA infette da SPBNGAK erano 5 e 10 volte superiori rispetto alle cellule NA infette da SPBNGAK.[ 52 ] Ulteriori prove di una correlazione inversa tra patogenicità e tasso di sintesi dell'RNA virale e produzione di particelle virali sono state fornite da topi infettati con virus ricombinanti chimerici in cui i geni G e M del ceppo SN attenuato sono stati sostituiti da quelli del ceppo SB altamente patogeno. Questi esperimenti hanno rivelato un aumento significativo della patogenicità del ceppo SN parentale portatore di RV G rispetto al ceppo SB patogeno. La patogenicità è stata ulteriormente aumentata quando sia G che M da SB sono stati introdotti in SN.
La sostituzione di G o M o di entrambi in SN con i geni corrispondenti di SB è stata associata a una significativa riduzione del tasso di produzione di particelle virali e del tasso di sintesi di RNA virale. Questi dati indicano che sia G che M svolgono un ruolo importante nella patogenesi di RV regolando la replicazione virale. La scoperta che la sostituzione di G o G più M in SN con G o G più M di SB determina una riduzione da moderata a forte rispettivamente della trascrizione e della replicazione dell'RNA virale, mentre la sostituzione di M da solo in SN con M di SB determina un forte aumento della trascrizione e della replicazione dell'RNA virale, indica che RV G ha anche un'importante funzione regolatrice nella trascrizione/replicazione dell'RNA virale, da sola o attraverso l'interazione con la proteina M. Il meccanismo con cui il gene RV G controlla la sintesi di RNA virale è sconosciuto. Alcune sequenze nucleotidiche all'interno dei geni RV G, come quelle che includono i codoni per Arg333 e Lys 194, sono state identificate come bersagli per i miRNA cellulari. È stato dimostrato che il riconoscimento del bersaglio da parte dei miRNA cellulari può comportare una regolazione positiva o negativa della replicazione virale. [ 53 ] Le sostituzioni Arg 333 → Glu 333 o Lys 194 → Ser 194 all'interno della sequenza del gene RV G comportano l'abolizione delle sequenze bersaglio dei miRNA, che a sua volta è associata a un aumento significativo del tasso di sintesi dell'RNA virale [Faber M, Thomas Jefferson University, PA, USA, dati non pubblicati], suggerendo che i miRNA cellulari dell'ospite svolgono anche un ruolo importante nella regolazione della replicazione di RV, come è stato dimostrato per altri virus a RNA tra cui il virus della stomatite vescicolare e l'HCV. [ 54 ], [ 55 ]
La regolazione della replicazione virale sembra essere uno dei meccanismi più importanti coinvolti nella patogenesi del virus della ricomparsa (RV). Per eludere la risposta immunitaria e preservare l'integrità della rete neuronale, i ceppi patogeni di RV, ma non i ceppi attenuati, possono regolare il proprio tasso di crescita. Un tasso di replicazione inferiore probabilmente avvantaggia i ceppi patogeni di RV, preservando la struttura neuronale che questi virus utilizzano per raggiungere il sistema nervoso centrale. Un'altra spiegazione del tasso di replicazione inferiore del RV patogeno è che, per eludere la diagnosi precoce da parte del sistema immunitario dell'ospite, il virus mantiene livelli minimi di espressione dei suoi antigeni.
Relazione tra espressione di RV G, apoptosi e patogenicità
È noto che i ceppi del virus della rabbia di strada che sono significativamente più patogeni rispetto ai ceppi adattati alla coltura tissutale esprimono livelli molto limitati di G e non inducono apoptosi fino a una fase avanzata del ciclo infettivo, suggerendo che la patogenicità di un particolare ceppo virale è inversamente correlata all'espressione di RV G e alla capacità di indurre apoptosi.[ 56 ] Una prova diretta di una correlazione tra il livello di espressione di G e l'entità dell'apoptosi è stata ottenuta con il RV ricombinante SPBNGA-GA, che trasportava due geni G identici e sovraesprimeva RV G.[ 57 ] Studi morfologici di colture neuronali infette con questo RV ricombinante hanno mostrato che la morte cellulare era significativamente aumentata parallelamente alla sovraespressione di RV G e che l'apoptosi è il principale meccanismo coinvolto nella morte mediata da RV G. In particolare, la diminuzione della colorazione dell'F-actina dopo l'infezione da SPBNGA-GA è coerente con la depolimerizzazione dei filamenti di actina indotta dall'apoptosi. Inoltre, il numero di nuclei TUNEL-positivi nei neuroni infetti da SPBNGA-GA è risultato significativamente aumentato rispetto a quello nei neuroni non infetti e infetti da SPBNGA. Tuttavia, il meccanismo con cui il gene RV G media il processo di segnalazione apoptotica rimane in gran parte sconosciuto. È stato suggerito che l'espressione di RV G al di sopra di una certa soglia distrugga gravemente la membrana cellulare. È altamente probabile che le cellule apoptotiche non vengano eliminate rapidamente nel SNC e quindi subiscano necrosi secondaria. [ 58 ] D'altra parte, l'infezione da RV e in particolare la sovraespressione della proteina RV G possono portare alla piroptosi, una via di morte cellulare simile all'apoptosi che, a differenza dell'apoptosi, coinvolge l'attivazione della caspasi 1 e quindi porta alla necrosi. [ 59 ] Il grado di necrosi o piroptosi indotto dall'infezione da RV gioca probabilmente un ruolo critico nell'induzione dell'immunità antivirale. Mentre le cellule apoptotiche mantengono l’integrità della loro membrana e non stimolano la risposta immunitaria innata, le cellule necrotiche diventano permeabili e secernono adiuvanti endogeni che possono innescare una robusta risposta immunitaria innata. [ 60 ]
Poiché il livello di apoptosi/necrosi è correlato all'immunogenicità del RV, è stato suggerito che l'effetto immunostimolante delle cellule apoptotiche/necrotiche contribuisca molto probabilmente alla generazione di una risposta immunitaria protettiva. Pertanto, la regolazione dell'espressione di RV G è molto probabilmente un fattore importante nella patogenesi della rabbia, in quanto fornisce un mezzo per la sopravvivenza e la diffusione delle varianti patogene di RV nel sistema nervoso senza causare danni neuronali evidenti e suscitando una risposta immunitaria protettiva che preverrebbe l'infezione.
L'espressione di RV G può essere regolata a livello di sintesi dell'RNA, a livello post-traduzionale o in entrambi i casi. È stato dimostrato che i livelli di RV G espressi da diverse varianti chimeriche di RV si riflettono sulla velocità di sintesi dell'RNA virale, suggerendo che la regolazione differenziale dell'espressione di RV G da parte di queste varianti derivi da variazioni nella velocità di trascrizione dell'mRNA virale. Come per i tassi di trascrizione dell'RNA virale, la quantità di RV G espressa da queste varianti è inversamente correlata alla patogenicità virale. D'altra parte, l'infezione di colture neuronali primarie con la variante di RV meno patogena CVS-B2c ha determinato livelli di proteina G quattro volte superiori rispetto all'infezione con la variante altamente patogena CVS-N2c, nonostante la sintesi di livelli comparabili di mRNA G in entrambe le infezioni. Esperimenti di pulse-chase hanno dimostrato che i livelli più elevati di proteina G nei neuroni infettati da CVS-B2c erano in gran parte dovuti a una minore velocità di degradazione della proteina G di CVS-B2c rispetto a quella di CVS-N2c. Tuttavia, il meccanismo che porta alla più rapida degradazione proteolitica della proteina G di CVS-N2c resta da chiarire.
Sintomi rabbia
Il periodo di incubazione della rabbia è in media di 30-90 giorni. In caso di infezione massiva attraverso ampie ferite alla testa e al viso, può essere ridotto a 12 giorni. In rari casi, il periodo di incubazione può durare 1 anno o più.
Si verifica un alternarsi rigorosamente sequenziale dei tre periodi della malattia: prodromo, eccitazione, paralisi.
Il periodo prodromico inizia con la comparsa di dolore lancinante o tirante nella sede del morso, nonché dolore lungo i nervi. Nell'area della cicatrice, possono verificarsi bruciore, prurito, talvolta arrossamento e gonfiore. Il paziente avverte malessere generale, mal di testa e nausea. Si notano vomito, aumento della temperatura corporea a 37,5-38 °C e sintomi di un disturbo mentale progressivo: aumento dell'eccitabilità riflessa, un'inspiegabile sensazione di ansia, paura e malinconia. Spesso il paziente è depresso, inibito, introverso, rifiuta di mangiare, dorme male, lamenta pensieri cupi e sogni spaventosi. Il periodo prodromico dura 2-3 giorni, a volte fino a 7 giorni. Al termine di questo periodo, possono verificarsi attacchi d'ansia con difficoltà respiratorie di breve durata, sensazione di oppressione toracica, accompagnata da tachicardia e aumento della frequenza respiratoria.
Il periodo di eccitazione è caratterizzato dalla comparsa di idrofobia: quando cerca di bere, e poi alla vista dell'acqua o a un ricordo di essa, il paziente avverte uno spasmo convulso della faringe e della laringe, durante il quale getta via il boccale d'acqua con un grido, getta in avanti le mani tremanti, getta indietro la testa e il corpo. Il collo è teso, una smorfia dolorosa deforma il viso, che diventa bluastro a causa di uno spasmo dei muscoli respiratori. Gli occhi sono sporgenti, esprimono paura, implorano aiuto, le pupille sono dilatate, l'inspirazione è difficile. Al culmine dell'attacco, è possibile l'arresto cardiaco e respiratorio. L'attacco dura diversi secondi, dopodiché le condizioni del paziente sembrano migliorare. Successivamente, attacchi di spasmi dei muscoli della laringe e della faringe possono verificarsi anche a causa del movimento dell'aria (aerofobia), della luce intensa (fotofobia) o di una parola pronunciata ad alta voce (acusticofobia). Gli attacchi sono accompagnati da agitazione psicomotoria, durante la quale il paziente si comporta come un "pazzo". La coscienza è annebbiata durante l'attacco, ma si schiarisce nel periodo interictale. Durante il periodo di agitazione, a causa dell'aumento del tono del sistema nervoso simpatico, i pazienti sperimentano un forte aumento della salivazione (scialorrea) con l'incapacità di deglutire la saliva a causa dello spasmo dei muscoli faringei. Il paziente spruzza saliva. Alcuni pazienti possono sviluppare segni di meningismo e persino opistotono, e le convulsioni sono comuni. In questo caso, il liquido cerebrospinale potrebbe non subire alterazioni, ma in alcuni pazienti la concentrazione proteica può aumentare e il numero di cellule può aumentare a causa dei linfociti.
Senza un trattamento adeguato, i segni di disidratazione aumentano, i tratti del viso si accentuano e il peso corporeo diminuisce. La temperatura corporea raggiunge valori elevati. Sono possibili convulsioni. La fase di eccitazione dura circa 2-3 giorni, raramente 4-5 giorni. Un esito fatale si verifica solitamente durante uno degli attacchi. Raramente, il paziente sopravvive fino al terzo stadio della malattia.
Durante il periodo di paralisi, il paziente si calma. Gli attacchi di idrofobia cessano, il paziente può bere e deglutire cibo, la coscienza è lucida. Tuttavia, nonostante l'apparente benessere, aumentano letargia, apatia e depressione, si manifestano presto paralisi degli arti, disturbi pelvici e paralisi dei nervi cranici. La temperatura corporea sale a 42-43 °C, la pressione arteriosa diminuisce e, entro la fine del primo giorno, sopraggiunge la morte per paralisi dei centri cardiovascolari e respiratori.
Nel sangue periferico si osservano leucocitosi neutrofila, aumento dell'emoglobina, degli eritrociti e dell'ematocrito.
Cosa ti infastidisce?
Forme
Clinicamente, si distinguono forme tipiche e atipiche. Le forme atipiche includono tutti i casi senza eccitazione e idrofobia. Le forme atipiche includono bulbare, cerebellare, meningoencefalitica, ecc.
Diagnostica rabbia
La diagnosi di rabbia si ottiene rilevando l'antigene, gli anticorpi, l'RNA virale o l'isolamento del virus. Poiché qualsiasi test può risultare negativo in un paziente affetto da rabbia, a volte sono necessari prelievi seriali di siero per la rilevazione degli anticorpi anti-rabbici, prelievi di saliva per la coltura virale e biopsia cutanea per l'immunofluorescenza diretta per l'antigene virale, soprattutto in caso di forte sospetto di rabbia.
Uno dei metodi più rapidi per diagnosticare la rabbia antemortem negli esseri umani è l'esecuzione di un test di immunofluorescenza diretta su una biopsia cutanea della nuca per rilevare l'antigene della rabbia. Il test di immunofluorescenza diretta è il metodo più sensibile e specifico per rilevare l'antigene della rabbia nella pelle e in altri tessuti freschi (ad esempio, biopsia cerebrale), sebbene i risultati possano occasionalmente essere negativi nelle fasi iniziali della malattia. Se non è disponibile tessuto fresco, la digestione enzimatica di tessuti fissati può aumentare la reattività del test di immunofluorescenza; tuttavia, la sensibilità può essere inaccettabilmente bassa.
La diagnosi può essere stabilita anche se il virus viene isolato dalla saliva dopo l'inoculazione di cellule di neuroblastoma o di roditori da laboratorio; questo è solitamente più efficace durante le prime 2-3 settimane di malattia. Anche la rilevazione di anticorpi neutralizzanti il virus della rabbia, solitamente eseguita tramite il test di inibizione rapida del focus fluorescente (RFFIT), nel siero di individui non vaccinati è diagnostica. La presenza di anticorpi nel liquido cerebrospinale conferma la diagnosi, ma possono comparire 2-3 giorni dopo rispetto agli anticorpi sierici e possono quindi essere meno utili nelle fasi precoci della malattia. Mentre la risposta sierologica successiva alla vaccinazione è generalmente indistinguibile dalla risposta sierologica indotta dalla malattia, la vaccinazione di solito non produce anticorpi contro il liquido cerebrospinale.
Solo sette casi di "guarigione" dalla rabbia negli ultimi 25 anni sono stati ben documentati. Sebbene il virus della rabbia non sia stato isolato in nessuno dei pazienti, gli alti titoli di anticorpi neutralizzanti la rabbia nei campioni di siero e la presenza di anticorpi neutralizzanti nel liquido cerebrospinale hanno fortemente supportato la diagnosi.
Cosa c'è da esaminare?
Quali test sono necessari?
Diagnosi differenziale
La diagnosi di rabbia umana viene solitamente formulata sulla base di dati epidemiologici e clinici e confermata in laboratorio. La diagnosi è immediata se vi è un'anamnesi di morsi di animali e si è manifestato l'intero spettro di sintomi e segni. In caso contrario, è necessaria una valutazione attenta ma rapida delle caratteristiche epidemiologiche e cliniche dei casi meno tipici prima di eseguire test di laboratorio specifici. Qualsiasi paziente con segni o sintomi neurologici o encefalite inspiegabile deve essere interrogato sulla possibilità di esposizione ad animali in aree endemiche per la rabbia all'interno o all'esterno del paese di residenza. Il mancato sospetto di rabbia in diversi recenti decessi umani negli Stati Uniti potrebbe essere dovuto alla mancanza di un'accurata anamnesi di esposizione.
All'esordio della malattia, la rabbia può imitare molte malattie infettive e non infettive. Molte altre encefaliti, come quelle causate da herpesvirus e arbovirus, assomigliano alla rabbia. Anche altre malattie infettive possono imitare la rabbia, come il tetano, la malaria cerebrale, la rickettsiosi e la febbre tifoide. Le malattie infettive paralitiche che possono essere confuse con la rabbia includono la poliomielite, il botulismo e l'encefalite simian-B erpetica.
Le malattie non infettive che possono essere confuse con la rabbia includono diverse sindromi neurologiche, in particolare la polineuropatia infiammatoria acuta (sindrome di Guillain-Barré), nonché l'encefalomielite allergica post-vaccinazione secondaria a vaccinazione antirabbica del tessuto nervoso, avvelenamento o intossicazione da farmaci, astinenza da alcol, porfiria acuta e isteria rabbiosa. La sindrome di Guillain-Barré può essere confusa con la rabbia paralitica e viceversa.
Chi contattare?
Trattamento rabbia
Non è stato sviluppato alcun trattamento per la rabbia. La somministrazione di dosi elevate di immunoglobuline antirabbiche specifiche e interferone leucocitario è inefficace. Per alleviare le sofferenze del paziente, viene somministrato un trattamento sintomatico. A tal fine, il paziente viene ricoverato in un reparto o in una camera separata e viene instaurato un regime protettivo che limita l'influenza dell'ambiente esterno (rumore ridotto, luce intensa, ventilazione). Per ridurre l'eccitabilità del sistema nervoso centrale, vengono prescritti sonniferi, anticonvulsivanti e antidolorifici. Il bilancio idrico viene normalizzato.
Nella fase paralitica, vengono prescritti farmaci che stimolano l'attività del sistema cardiovascolare e respiratorio. Si raccomanda l'uso di ossigenazione iperbarica, ipotermia cerebrale e respirazione meccanica controllata con curarizzazione completa del paziente. Tuttavia, tutti i metodi di trattamento sono praticamente inefficaci. Nel migliore dei casi, è possibile prolungare la vita del paziente di diversi mesi. Un esito sfavorevole è predeterminato dalla gravità del danno al tronco encefalico con la distruzione dei centri vitali.
Prevenzione
Lo sviluppo del primo vaccino antirabbico da parte di Pasteur nel 1885 ha inaugurato un'era di controllo della rabbia molto più efficace. Oggi, nonostante il tasso di mortalità per rabbia negli esseri umani sia prossimo al 100%, la malattia è completamente prevenibile attraverso la vaccinazione pre e/o post esposizione. Mentre Pasteur e i suoi colleghi avviarono la vaccinazione dei cani privati a Parigi, la prima vaccinazione di massa dei cani fu effettuata all'inizio degli anni '20 in Giappone, segnando il primo importante programma nazionale di controllo della rabbia. La vaccinazione orale degli animali selvatici, sviluppata per la prima volta negli anni '70, ha da allora ripetutamente dimostrato di controllare efficacemente la malattia nei principali ospiti terrestri come volpi, procioni e puzzole.[ 68 ] La vaccinazione antirabbica prolungata delle popolazioni di animali serbatoio con tassi di copertura del 70% o superiori eliminerà infine il virus della rabbia dalle specie serbatoio e impedirà la diffusione del virus agli ospiti incidentali.[ 69 ]
I dati filogenetici indicano che i lyssavirus hanno infettato i pipistrelli molto prima di infettare i mammiferi terrestri e la maggior parte dei lyssavirus, incluso il RABV, circola ancora in varie specie di pipistrelli in tutto il mondo.[ 70 ] Tuttavia, metodi efficaci per prevenire la trasmissione del RABV tra i pipistrelli rimangono elusivi, precludendo la possibilità di una completa eradicazione della rabbia in questo momento. Tuttavia, anche dopo l'esposizione al RABV attraverso il morso di un mammifero infetto da rabbia, una profilassi post-esposizione sicura ed efficace (PEP, che include la pulizia delle ferite, l'immunoglobulina antirabbica e la vaccinazione antirabbica) può proteggere gli esseri umani dall'infezione da rabbia se il trattamento viene somministrato tempestivamente e secondo le raccomandazioni dell'Organizzazione Mondiale della Sanità (OMS).
Questi due metodi di prevenzione dei decessi umani – uno basato sulla vaccinazione delle persone esposte e l'altro sulla vaccinazione di un numero sufficiente di cani da interrompere il ciclo di trasmissione alla fonte – costituiscono i pilastri portanti di un approccio "one health" alla prevenzione e al controllo della rabbia canina. Questi due diversi metodi di prevenzione dei decessi umani sono stati considerati come alternative distinte: la Strategia A, basata sulla fornitura di PEP alle persone, e la Strategia B, basata sulla vaccinazione dei cani; oppure come componenti di una Strategia A + B combinata in un'analisi dei probabili costi delle strategie alternative.[ 71 ]
Paesi come la Thailandia hanno avuto un enorme successo nel prevenire i decessi umani attraverso l'uso della PEP, ma hanno anche riscontrato un aumento della domanda e dei costi associati all'uso della sola PEP. [ 72 ] Ad esempio, rispetto alla situazione del 1991, nel 2003 quattro volte più persone (più di 400.000) avevano bisogno della PEP. Dati recenti mostrano che la Repubblica Popolare Cinese, che vaccina 15 milioni di persone all'anno dopo una potenziale esposizione alla rabbia, spende circa 650 milioni di dollari all'anno solo per la PEP. [ 73 ]
Un approccio molto più sostenibile consiste nel prevenire la diffusione dell'infezione alla fonte, nella popolazione animale, aumentando al contempo l'accesso alla PEP per i pazienti umani esposti quando necessario. Laddove vi sia volontà politica e finanziamenti adeguati per controllare la rabbia canina, i decessi possono essere eliminati e sono stati eliminati. L'uso diffuso della vaccinazione canina ha portato all'eliminazione della rabbia canina da diversi paesi, tra cui la Malesia nel 1954, [ 74 ] il Giappone nel 1956, Taiwan nel 1961, Singapore e, in particolare, in tutta l'Europa occidentale (rivista in Rupprecht et al, King et al e Gongal e Wright). [ 75 ]
Использованная литература


 [
[