Esperto medico dell'articolo
Nuove pubblicazioni
Sindrome da iperstimolazione ovarica
Ultima recensione: 05.07.2025

Tutti i contenuti di iLive sono revisionati o verificati da un punto di vista medico per garantire la massima precisione possibile.
Abbiamo linee guida rigorose in materia di sourcing e colleghiamo solo a siti di media affidabili, istituti di ricerca accademici e, ove possibile, studi rivisti dal punto di vista medico. Nota che i numeri tra parentesi ([1], [2], ecc.) Sono link cliccabili per questi studi.
Se ritieni che uno qualsiasi dei nostri contenuti sia impreciso, scaduto o comunque discutibile, selezionalo e premi Ctrl + Invio.
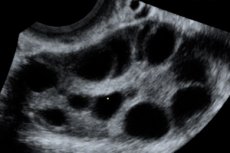
La sindrome da iperstimolazione ovarica (OHSS) è una complicanza iatrogena basata sulla risposta iperergica incontrollata delle ovaie alla somministrazione di gonadotropine nei cicli di stimolazione dell'ovulazione e nei programmi di riproduzione assistita.
La sindrome può manifestarsi dopo l'induzione dell'ovulazione con clomifene o all'inizio della gravidanza in un ciclo spontaneo.
 [ 1 ]
[ 1 ]
Epidemiologia
L'incidenza della sindrome da iperstimolazione ovarica varia dallo 0,5 al 14% con diversi schemi di stimolazione dell'ovulazione e non tende a diminuire. La malattia ha diversi gradi di gravità e può essere fatale a causa dello sviluppo di complicanze tromboemboliche o ARDS. Il tasso di mortalità atteso è di 1 su 450-500.000 donne. Forme gravi della sindrome, che richiedono il ricovero in terapia intensiva, si verificano nello 0,2-10%. Secondo il Registro Nazionale Russo delle Tecnologie di Riproduzione Assistita, l'incidenza di OHSS grave nel 2004 era del 5,6%.
Cause della sindrome da iperstimolazione ovarica
Fattori di rischio per lo sviluppo della sindrome da iperstimolazione ovarica:
- età inferiore a 35 anni,
- fisico astenico,
- la presenza di ovaie policistiche o multifollicolari,
- maturazione di più di dieci follicoli nel protocollo di stimolazione dell'ovulazione,
- uso di farmaci agonisti dell'ormone di rilascio delle gonadotropine e dosi elevate di gonadotropine,
- l'inizio della gravidanza,
- supporto della fase luteale con preparati hCG,
- malattie allergiche.
Come si sviluppa la sindrome da iperstimolazione ovarica?
La sindrome da iperstimolazione ovarica si verifica sullo sfondo di una concentrazione anormalmente elevata di ormoni sessuali nel plasma sanguigno, che influisce negativamente sulle funzioni di vari apparati, principalmente le ovaie, ed è caratterizzata da un aumento delle dimensioni delle ovaie, talvolta fino a 20-25 cm di diametro, con la formazione di cisti follicolari e luteali in esse, sullo sfondo di un pronunciato edema stromale. Il fattore scatenante dello sviluppo della sindrome è la somministrazione di una dose ovulatoria di gonadotropina corionica. Lo sviluppo della sindrome si basa sul fenomeno di "aumento della permeabilità vascolare", che porta a un massiccio rilascio di liquido ricco di proteine nel terzo spazio, l'interstizio, e alla sua deposizione con sviluppo di ipovolemia, emoconcentrazione, oliguria, ipoproteinemia, squilibrio elettrolitico, aumento dell'attività degli enzimi epatici, formazione di ascite, idrotorace, idropericardio con o senza shock ipovolemico. Tuttavia, il "fattore X" che causa la trasudazione di liquidi rimane sconosciuto. Nei casi gravi, si verificano anasarca, insufficienza renale acuta, complicanze tromboemboliche e sindrome da distress respiratorio acuto (ARDS).
Attualmente, la sindrome da iperstimolazione ovarica è considerata dal punto di vista della SIRS, sullo sfondo della quale si verifica un massiccio danno endoteliale. Nelle pazienti con OHSS, sono state riscontrate nel trasudato peritoneale elevate concentrazioni di interleuchine (IL-1, IL-2, IL-6, IL-8) e fattori di necrosi tumorale (TNF-α, TNF-(3)), che aumentano la sintesi di prostaglandine da parte delle ovaie, la neovascolarizzazione ovarica e la permeabilità vascolare. Sotto l'influenza di citochine proinfiammatorie, si verifica un'attivazione sistemica dei processi della coagulazione. L'entità della leucocitosi è correlata alla gravità della SIRS. Il danno organo-sistemico nella OHSS è simile al danno che si verifica nella sepsi. Il ruolo del fattore microbico nella OHSS e il suo contributo allo sviluppo della SIRS sono attualmente oggetto di discussione. Si ritiene che i microrganismi che colonizzano l'intestino e il tratto genitourinario possano penetrare oltre il loro habitat e avere effetti sull'organismo simili a quelli della sepsi.
Sintomi della sindrome da iperstimolazione ovarica
La gravità della sindrome è direttamente correlata alla gravità dei disturbi emodinamici che causano il quadro clinico. L'esordio della sindrome può essere graduale con un peggioramento dei sintomi o improvviso (acuto), in cui si verifica una brusca ridistribuzione dei liquidi corporei entro poche ore, con accumulo nelle cavità sierose. Quando la sindrome si manifesta, si presentano sintomi quali debolezza, vertigini, mal di testa, "mosche" guizzanti davanti agli occhi, mancanza di respiro a riposo e durante lo sforzo fisico, tosse secca che si intensifica in posizione supina, secchezza delle fauci, nausea, vomito, diarrea, gonfiore, sensazione di distensione, tensione, dolore addominale spesso senza una chiara localizzazione, minzione rara, febbre, gonfiore dei genitali esterni e degli arti inferiori.
Nelle pazienti con sindrome da iperstimolazione ovarica, l'insufficienza respiratoria può svilupparsi a causa della mobilità polmonare limitata dovuta ad ascite, ingrossamento ovarico o versamento pleurico. Il decorso della OHSS grave nella fase di manifestazione può essere complicato da idrotorace acuto, ARDS, embolia polmonare, atelettasia ed emorragia intra-alveolare. Il versamento pleurico viene diagnosticato in circa il 70% delle donne con OHSS da moderata a grave e può essere monolaterale o bilaterale e si verifica in concomitanza con ascite. Nella OHSS sono stati descritti dislocamento e compressione degli organi mediastinici dovuti a massivo versamento pleurico destro con sviluppo di shock, così come un esito fatale in una donna con OHSS e idrotorace dovuto ad atelettasia, emorragia massiva nel lume alveolare.
Disturbi emodinamici. Nella OHSS moderata e grave si verificano ipotensione arteriosa e tachicardia.
Ascite. L'addome è disteso, spesso teso, dolente in tutte le sedi, ma più spesso nell'ipogastrio, nella proiezione delle ovaie.
Disfunzione renale ed epatica. Si osservano ritenzione urinaria, oliguria, anuria, epatomegalia.
Il decorso dell'OHSS nell'80% dei pazienti con una forma grave della sindrome è accompagnato da febbre. Nel 20% delle donne, la febbre si verifica sullo sfondo di un'infezione delle vie urinarie, nel 3,8% a causa di polmonite, nel 3,3% a un'infezione delle vie respiratorie superiori. La tromboflebite dovuta all'inserimento di un catetere endovenoso causa febbre nel 2% dei pazienti, l'infiammazione del grasso sottocutaneo nel sito di puntura della parete addominale durante laparocentesi nell'1% dei pazienti. L'infezione della ferita chirurgica si verifica nell'1% dei pazienti e gli ascessi post-iniezione (somministrazione intramuscolare di progesterone) nello 0,5%. La febbre di origine non infettiva in un paziente su due con OHSS è probabilmente associata a meccanismi pirogeni endogeni. Sono stati descritti casi isolati di sepsi in pazienti con OHSS grave.
Sullo sfondo dello sviluppo della sindrome si verifica un'esacerbazione delle malattie somatiche croniche latenti.
Cosa ti infastidisce?
Classificazione
Non esiste una classificazione univoca della sindrome da iperstimolazione ovarica. Sulla base dei sintomi clinici e di laboratorio, si distinguono quattro gradi di gravità della sindrome:
- OHSS lieve. Disturbi addominali, ovaie fino a 8 cm di diametro con o senza cisti, parametri di laboratorio normali. L'OHSS lieve è definita "iperstimolazione ovarica controllata", poiché questa condizione si osserva in tutti i cicli di superovulazione e attualmente non è considerata una sindrome patologica che richieda un trattamento.
- OHSS moderata. Dolore moderato in tutte le parti dell'addome, nausea, vomito, diarrea, ovaie di 8-12 cm di diametro con cisti, ecografia e/o segni clinici di ascite, ematocrito non superiore al 45%, leucocitosi - 10-16x10 9 /l, ipercoagulazione (D-dimero - superiore a 0,5 μg/ml, concentrazione di fibrinogeno - superiore a 400 mg/dl, APTT, INR - nei limiti della norma).
- OHSS grave. Ematocrito superiore al 45%, leucocitosi 17-24x10 9 /l, ipercoagulazione (D-dimero superiore a 5 μg/ml, fibrinogeno superiore a 600 mg/dl), ovaie di diametro superiore a 12 cm con cisti, tutti i segni clinici e di laboratorio di OHSS moderata e ascite tesa, idrotorace, disfunzione epatica, oliguria [diuresi inferiore a 0,5 ml/(kg h)].
- OHSS critica. Ematocrito superiore al 55%, leucocitosi superiore a 25x109/l, ascite tesa, idrotorace bilaterale, idropericardio, anasarca, ovaie ingrossate fino a 20-25 cm, oliguria o anuria, insufficienza renale acuta, complicanze tromboemboliche, sindrome da distress respiratorio acuto (ARDS).
Anche la sindrome da iperstimolazione ovarica si divide in precoce e tardiva.
Se l'OHSS si verifica in fase luteale e non si verifica l'impianto, la sindrome scompare improvvisamente e spontaneamente con l'inizio delle mestruazioni, raramente raggiungendo una forma grave. Se si verifica l'impianto, il più delle volte si osserva un peggioramento delle condizioni della paziente durante le prime 12 settimane di gravidanza. L'OHSS tardiva è causata da un aumento significativo dell'hCG nel plasma sanguigno ed è solitamente associata all'impianto e alle fasi iniziali della gravidanza.
Conseguenze e complicazioni
Le complicanze della sindrome da iperstimolazione ovarica possono portare allo sviluppo di complicanze tromboemboliche. La causa della trombosi nella OHSS rimane sconosciuta, ma il ruolo principale nella patogenesi di questa condizione è attribuito ad alte concentrazioni di ormoni sessuali, citochine proinfiammatorie, emoconcentrazione e riduzione della pressione arteriosa ventricolare (VCP). Lunghi periodi di ospedalizzazione, attività motoria limitata, ridotto ritorno venoso dovuto a un aumento delle ovaie, un aumento dell'attività dei fattori della coagulazione, degli inibitori della fibrinolisi e delle piastrine contribuiscono ulteriormente all'elevato rischio di sviluppare complicanze trombotiche associate alla OHSS. È stato dimostrato che nell'84% delle pazienti con complicanze tromboemboliche insorte dopo l'induzione dell'ovulazione e nei programmi di tecniche di riproduzione assistita, il loro sviluppo si è verificato in concomitanza con la gravidanza. Nel 75% dei casi, la formazione di trombi è stata osservata nel letto venoso con una localizzazione predominante nei vasi degli arti superiori, del collo e della testa (60%). In un certo numero di pazienti è stata diagnosticata una trombosi arteriosa spontanea localizzata nei vasi cerebrali. Meno frequentemente, sono stati osservati trombi nelle arterie femorale, poplitea, carotide, succlavia, iliaca, ulnare, mesenterica e aorta. La letteratura riporta l'osservazione dello sviluppo di occlusione dell'arteria retinica centrale con perdita della vista nella OHSS. L'incidenza di embolia polmonare nei pazienti con OHSS e trombosi venosa profonda degli arti inferiori è del 29%, mentre nelle donne con OHSS e trombosi venosa profonda degli arti superiori e trombosi arteriosa, il rischio di questa complicanza è significativamente inferiore ed è rispettivamente del 4 e dell'8%.
I casi gravi di sindrome da iperstimolazione ovarica possono essere accompagnati da complicazioni che richiedono un intervento chirurgico: rottura di una cisti ovarica e sanguinamento intra-addominale, torsione degli annessi uterini, gravidanza ectopica.
Diagnosi della sindrome da iperstimolazione ovarica
La diagnosi della sindrome da iperstimolazione ovarica viene stabilita sulla base dei dati anamnestici, di un esame clinico, di laboratorio e strumentale completo che rivela ovaie ingrossate con cisti multiple, emoconcentrazione pronunciata e ipercoagulazione in una paziente che ha utilizzato tecniche di riproduzione assistita o induzione controllata dell'ovulazione in questo ciclo per ottenere una gravidanza.
Ricerca di laboratorio
Esame clinico del sangue
Ematocrito superiore al 40%, concentrazione di emoglobina superiore a 140 g/l, leucocitosi fino a 50x10 9 /l senza deviazione a sinistra, trombocitosi fino a 500-600x10 6 /l. L'emoconcentrazione (ematocrito superiore al 55%) indica una potenziale minaccia per la vita.
Esame del sangue biochimico
Squilibrio elettrolitico, tra cui iperkaliemia (superiore a 5,3 mmol/l) e iponatriemia (superiore a 135 mmol/l), che porta a una riduzione dell'osmolarità plasmatica. Ipoproteinemia (proteine totali superiori a 66 g/l), ipoalbuminemia (albumina inferiore a 35 g/l), proteina C-reattiva elevata, aumento delle transaminasi epatiche fino a 800 U/l, in alcuni casi aumento della GGT o della fosfatasi alcalina, in alcuni pazienti aumento della concentrazione di creatinina superiore a 80 μmol/l e dell'urea superiore a 8,3 mmol/l.
 [ 20 ], [ 21 ], [ 22 ], [ 23 ]
[ 20 ], [ 21 ], [ 22 ], [ 23 ]
Coagulogramma
Livelli di fibrinogeno aumentati oltre 400 mg/dl, fattore di von Willebrand superiore al 140%, concentrazioni di antitrombina III ridotte sotto l'80%, D-dimero superiore a 0,5 mcg/ml. Valori normali per APTT, PTI, INR.
 [ 24 ]
[ 24 ]
Immunoglobuline del sangue
Diminuzione della concentrazione di IgG e IgA nel plasma sanguigno. Esame delle urine generale. Proteinuria.
Analisi della composizione del liquido ascitico
Elevato contenuto di proteine (oltre 42 g/l) e albumina (oltre 23 g/l), basso numero di globuli bianchi, numero relativamente alto di globuli rossi, elevate concentrazioni di tutte le citochine proinfiammatorie, proteina C-reattiva fino a 135 mg/l (normale 0-8,2 mg/l), frazione globulinica delle proteine.
 [ 25 ], [ 26 ], [ 27 ], [ 28 ], [ 29 ], [ 30 ], [ 31 ]
[ 25 ], [ 26 ], [ 27 ], [ 28 ], [ 29 ], [ 30 ], [ 31 ]
Marcatori tumorali nel plasma sanguigno
La concentrazione di CA-125, che riflette la massiccia proliferazione del tessuto ovarico, raggiunge i suoi valori massimi (fino a 5125 U/ml) entro la seconda settimana di sviluppo della sindrome da iperstimolazione ovarica (OHSS), quando entrambe le ovaie raggiungono il massimo volume. L'elevato livello del marcatore tumorale persiste fino a 15-23 settimane dopo la comparsa dei segni di sindrome da iperstimolazione ovarica, nonostante il trattamento.
La procalcitonina nel siero sanguigno viene rilevata nel 50% dei pazienti in un intervallo compreso tra 0,5 e 2,0 ng/ml, valore considerato una reazione infiammatoria sistemica moderata.
Ricerca microbiologica
Esaminando le urine secrete dalla vagina e dal canale cervicale, vengono isolati patogeni atipici Pseudomonas, Proteus, Klebsiella, Enterobacter, E. coli in quantità superiori a 10.000 CFU/ml.
Ricerca strumentale
Ecografia degli organi pelvici
Ovaie ingrossate da 6 a 25 cm di diametro con cisti multiple, utero di dimensioni normali o ingrossato, presenza di liquido libero nella cavità pelvica e gravidanza singola o multipla progressiva normale.
Ecografia degli organi addominali
Presenza di liquido libero nella cavità addominale in quantità da 1 a 5-6 litri. Normali dimensioni e struttura del fegato o epatomegalia. Segni ecografici di discinesia biliare. All'esame dei reni, il complesso caliceo-pelvico risulta invariato.
Ecografia delle cavità pleuriche
Presenza di liquido libero all'ecocardiografia. In presenza di disturbi emodinamici, riduzione della frazione di eiezione (EF), riduzione del volume telediastolico, riduzione del ritorno venoso, in alcuni casi si può riscontrare la presenza di liquido libero nella cavità pericardica.
ECG
Disturbi del ritmo come extrasistole ventricolare, tachicardia, alterazioni metaboliche ed elettrolitiche diffuse nel miocardio. Radiografia del torace. Eseguita in caso di sospetto di ARDS e tromboembolia. Un reperto radiografico caratteristico dell'ARDS è la comparsa di un quadro a "vetro smerigliato" e di infiltrati multifocali diffusi di densità piuttosto elevata (consolidamento) con bronchi aerei ben definiti, ovvero lo sviluppo di un danno esteso al parenchima polmonare. Nell'embolia polmonare, la radiografia rivela una posizione elevata della cupola diaframmatica, atelettasia discoide, pletora di una delle radici polmonari o una radice "troncata", deplezione del quadro polmonare sull'area ischemica del polmone e un'ombra triangolare periferica di infiammazione.
Indicazioni per la consultazione con altri specialisti
Dato il coinvolgimento di tutti gli organi e sistemi nel processo patologico, è obbligatoria la visita di un terapista. In caso di sospetta complicanze trombotiche, è necessario un consulto con un chirurgo vascolare. In presenza di idrotorace pronunciato, è necessario un consulto con un chirurgo toracico per decidere se eseguire una puntura pleurica.
Cosa c'è da esaminare?
Come esaminare?
Quali test sono necessari?
Trattamento della sindrome da iperstimolazione ovarica
L'assenza di un concetto chiaro della fisiopatologia della sindrome da iperstimolazione ovarica (OHSS) rende impossibile attuare un trattamento efficace e patogeneticamente comprovato che consenta di arrestare efficacemente e tempestivamente lo sviluppo della sindrome e dei disturbi multiorgano che accompagnano le forme gravi di sindrome da iperstimolazione ovarica. Attualmente, non esiste una terapia specifica per la sindrome da iperstimolazione ovarica, pertanto le misure terapeutiche per queste pazienti si riducono alla terapia patogenetica fino alla regressione spontanea della sindrome, in quanto la concentrazione di hCG nel plasma sanguigno diminuisce nell'arco di 7 giorni nei cicli in cui non si è verificata una gravidanza, o di 10-20 giorni in caso di gravidanza. La maggior parte delle pazienti ricoverate in terapia intensiva viene ricoverata con una diagnosi di OHSS dopo il trattamento ambulatoriale, che consiste nella valutazione quotidiana del peso e della diuresi, nella limitazione dell'attività fisica eccessiva e dell'attività sessuale, nell'assunzione abbondante di bevande alcoliche con l'aggiunta di soluzioni ricche di elettroliti e nell'esecuzione di esami del sangue periodici. La discussione sulla strategia di trattamento per questo gruppo di pazienti prevede un trattamento sintomatico completo volto a prevenire lo sviluppo di PRF ripristinando il CCP, eliminando l'emoconcentrazione, lo squilibrio elettrolitico, prevenendo l'insufficienza renale acuta, l'ARDS e le complicanze tromboemboliche.
Fase 1 - valutazione della gravità della condizione
Il primo passo per determinare la strategia di gestione di una paziente con sindrome da iperstimolazione ovarica è valutare l'emodinamica e la funzione respiratoria. È inoltre necessario condurre un esame obiettivo completo con uno studio approfondito delle condizioni degli arti, della testa e del collo per escludere una trombosi venosa profonda e installare un catetere venoso periferico o un cateterismo venoso centrale. Il cateterismo della vena succlavia è il più appropriato, poiché in questo caso il rischio di trombosi è il più basso. Il cateterismo vescicale è necessario per valutare la diuresi. È necessario esaminare quotidianamente i parametri ematochimici, gli elettroliti plasmatici, le proteine, l'attività degli enzimi epatici, la creatinina, i livelli di urea e i parametri del coagulogramma. Viene eseguita un'ecografia addominale per determinare il grado di ingrossamento ovarico e la presenza di ascite.
Fase 2 - terapia infusionale
La terapia farmacologica delle pazienti con OHSS deve essere mirata al mantenimento dell'emodinamica e alla mobilizzazione dei liquidi contenuti nella cavità addominale, creando un bilancio idrico e sodico negativo. L'obiettivo primario è quello di reintegrare il volume dei liquidi circolanti per ridurre l'emoconcentrazione e mantenere un'adeguata filtrazione renale. Soluzioni cristalloidi e colloidi vengono utilizzate per la terapia infusionale della sindrome da iperstimolazione ovarica.
La scelta della soluzione cristalloide è determinata dallo squilibrio elettrolitico. Nel determinare la quantità di cristalloidi somministrata, è necessario tenere presente che in condizioni di danno endoteliale generalizzato, il volume di queste soluzioni dovrebbe essere 2-3 volte inferiore a quello delle soluzioni colloidali, poiché la predominanza di cristalloidi aggrava l'accumulo di liquido nelle cavità sierose e, in alcuni casi, porta allo sviluppo di anasarca.
Il farmaco di scelta per il ripristino e il mantenimento del volume intravascolare nei pazienti con OHSS è l'amido idrossietilico 130/0,42 a volume giornaliero di 25-30 ml/kg. L'amido idrossietilico 200/0,5 può essere utilizzato anche nella terapia di base dell'OHSS a un volume di 20 ml/kg/die. Tuttavia, può accumularsi nell'organismo e, con un uso prolungato, può causare disfunzione epatica e aumentare i livelli di transaminasi epatiche, talvolta fino a 800 U/l. In questa tipologia di pazienti, l'uso di amido idrossietilico 450/0,7 è inappropriato a causa dell'elevato rischio di reazioni allergiche, dell'impatto negativo sulla funzionalità renale ed epatica e del deterioramento dei parametri emocoagulativi (prolungamento del tempo di coagulazione del sangue, rischio di complicanze emorragiche). Le indicazioni per l'uso di soluzioni di destrano sono limitate dall'elevata frequenza di reazioni allergiche, dall'impatto negativo sul sistema emostatico, dal rilascio del fattore di von Willebrand, dall'induzione della cascata proinfiammatoria e dalla mancanza di impatto sulle proprietà reologiche del sangue alle dosi utilizzate. L'infusione di destrani in condizioni di aumentata permeabilità capillare può portare allo sviluppo della cosiddetta sindrome da destrano, accompagnata da ipersensibilità al glucosio (OL), compromissione della funzionalità epatica e renale e sviluppo di coagulopatia. Le soluzioni di gelatina non sono inoltre destinate alla terapia infusionale nella OHSS.
Con ipoproteinemia inferiore a 25 g/l, si utilizza una soluzione di albumina al 20%, con un volume giornaliero di 3 ml/kg. Si raccomanda di utilizzare solo una soluzione di albumina al 20%, poiché la pressione oncotica di una soluzione al 20% è di circa 100 mmHg, mentre quella di una soluzione al 5% è di circa 20 mmHg. In condizioni di elevata permeabilità dell'endotelio vascolare, l'infusione di una soluzione di albumina al 5%, a differenza di una soluzione al 20%, determina uno scambio più intenso con il pool extravascolare e un brusco aumento della pressione oncotica nell'interstizio, con conseguente aumento dell'iperidratazione interstiziale dei polmoni.
I diuretici sono giustificati in caso di oliguria, edema periferico, con valori di ematocrito del 36-38%. La prescrizione prematura o eccessiva di diuretici può provocare un aggravamento dell'ipovolemia e dell'emoconcentrazione, aumentando il rischio di complicanze trombotiche. La furosemide è utilizzata principalmente alla dose di 20-40 mg una volta per via intramuscolare o endovenosa lenta per 1-2 minuti.
Principi della terapia infusionale per la sindrome da iperstimolazione ovarica
Dopo la somministrazione della dose iniziale di soluzioni cristalloidi e colloidi, il volume della successiva terapia infusionale viene determinato tenendo conto dei seguenti parametri: diuresi inferiore a 1 ml/(kg h), ematocrito inferiore al 40%, pressione arteriosa media superiore a 70 mm Hg, pressione venosa centrale compresa tra 8 e 10 mm H₂O. Una volta raggiunti i parametri specificati, la terapia infusionale viene interrotta. È consigliabile frazionare il volume giornaliero totale di soluzioni infusionali nell'arco della giornata. Il mancato rispetto di queste indicazioni comporta lo sviluppo di emodiluizione, che provoca un rapido accumulo di liquidi nelle cavità sierose e un peggioramento delle condizioni della paziente. Un errore tipico nel trattamento delle donne con OHSS è il prolungamento ingiustificato della terapia infusionale quando i parametri emodinamici si sono normalizzati e il tentativo di arrestare completamente lo sviluppo di OHSS come condizione iatrogena.
Fase 3 - prevenzione delle complicanze
Prevenzione della trombosi e del tromboembolismo
La base per prevenire le complicanze trombotiche nella sindrome da iperstimolazione ovarica è l'eliminazione dell'emoconcentrazione. La terapia antitrombotica è indicata quando compaiono segni di laboratorio di ipercoagulazione. L'eparina a basso peso molecolare (EBPM) viene utilizzata a questo scopo:
- nadroparina calcica (dose giornaliera - 100 UI anti-Xa/kg 2 volte per via sottocutanea),
- dalteparina sodica (100-150 UI anti-Xa/kg 2 volte per via sottocutanea),
- enoxaparina sodica (1 ml/kg/die) 1-2 volte per via sottocutanea).
Monitoraggio di laboratorio: determinazione dell'attività anti-Xa plasmatica 3 ore dopo la somministrazione di EBPM, che consente di mantenere una dose efficace del farmaco entro l'intervallo terapeutico di sicurezza e quindi di ridurre al minimo la probabilità di sanguinamento. I farmaci antitrombotici vengono continuati fino alla normalizzazione dei parametri della coagulazione del sangue. Il monitoraggio viene effettuato determinando la concentrazione plasmatica di D-dimero con metodo quantitativo. La durata della somministrazione di EBPM è determinata individualmente e in alcuni casi può superare i 30 giorni.
Prevenzione delle complicanze infettive
Considerando l'effetto positivo della prescrizione di preparati a base di immunoglobuline nella prevenzione delle infezioni secondarie in altre patologie associate a perdita di proteine, ci si può aspettare l'efficacia di questa terapia nei pazienti con OHSS. Tuttavia, per la conferma o la confutazione definitiva di questa ipotesi dal punto di vista della medicina basata sull'evidenza, è necessario condurre studi. Attualmente, l'indicazione per la terapia antibatterica empirica è il rischio di infezione secondaria nei pazienti in condizioni critiche o con emodinamica instabile. Il farmaco selezionato empiricamente viene modificato in base ai risultati dei test batteriologici. Quando si prescrive una terapia antibatterica empirica, è necessario basarsi sulle informazioni relative alla gravità della malattia, ai fattori di rischio per le infezioni e alle caratteristiche della resistenza agli antibiotici in una determinata unità di terapia intensiva.
Supporto nutrizionale
Viene somministrato per via orale a tutti i pazienti con OHSS grave e critica. È necessario seguire le seguenti raccomandazioni:
- valore energetico 25-35 kcal/(kgxgiorno),
- glucosio - inferiore a 6 g/(kg x giorno),
- lipidi - 0,5-1 g/(kg x giorno),
- proteine - 1,2-2 g/(kg x giorno),
- dose giornaliera standard di microelementi e vitamine.
Fase 4 - metodi chirurgici
Indicazioni per la laparocentesi nelle donne con sindrome da iperstimolazione ovarica:
- ascite tesa progressiva,
- oliguria inferiore a 0,5 ml/dkg/min),
- un aumento della concentrazione di creatinina superiore a 80 μmol/l o una diminuzione della sua clearance,
- emoconcentrazione con valore di ematocrito superiore al 40%, non suscettibile di correzione farmacologica.
Per la laparocentesi è possibile selezionare l'accesso transaddominale o transvaginale. Le ovaie ingrossate creano difficoltà tecniche, motivo per cui il controllo ecografico è estremamente importante. Il drenaggio a lungo termine della cavità addominale (laparocentesi transaddominale) da 14 a 30 giorni con rimozione frazionata del trasudato peritoneale con catetere apirogeno cystoFix® presenta numerosi vantaggi, in quanto consente di evitare l'evacuazione singola di un elevato volume di trasudato peritoneale, eliminando così le brusche fluttuazioni della pressione intra-addominale che causano disturbi emodinamici, stabilizzando le condizioni della paziente ed evitando ripetute punture della cavità addominale per rimuovere il liquido ascitico in questa categoria di pazienti. Il volume totale di liquido ascitico evacuato durante il trattamento della OHSS grave può variare da 30 a 90 litri.
Nelle pazienti con idrotorace in concomitanza con sindrome da iperstimolazione ovarica, è giustificato un approccio attendista. In caso di idrotorace, la puntura della cavità pleurica viene eseguita solo in caso di grave insufficienza respiratoria progressiva.
Criteri per l'inizio del supporto respiratorio nella sindrome da iperstimolazione ovarica grave e critica:
- mancanza di respirazione spontanea e ritmi respiratori patologici,
- diminuzione dell'indice respiratorio a meno di 200 mm Hg,
- aritmie cardiache potenzialmente letali,
- tachicardia persistente superiore a 120,
- ipotensione grave,
- tachipnea oltre i 40,
- coinvolgimento dei muscoli respiratori accessori.
In caso di sviluppo di ARDS e passaggio alla ventilazione meccanica, si utilizza quanto segue:
- piccoli volumi respiratori (6 ml/kg),
- pressione inspiratoria <30 cm H2O,
- PEEP (>10 cm H2O),
- Viene utilizzata la manovra di reclutamento alveolare.
Il trattamento chirurgico della sindrome da iperstimolazione ovarica è giustificato solo in presenza di patologia acuta con torsione dell'appendice, rottura della cisti ovarica o sanguinamento dalla cisti ovarica. In caso di torsione ovarica, la detorsione laparoscopica dell'ovaio è la più efficace. Un errore tipico nella strategia terapeutica per le pazienti con OHSS non complicata è la chirurgia d'urgenza con resezione di circa il 30-50% del tessuto ovarico o ovariectomia bilaterale.

