Esperto medico dell'articolo
Nuove pubblicazioni
Anemia ipofisaria (nanismo)
Ultima recensione: 12.07.2025

Tutti i contenuti di iLive sono revisionati o verificati da un punto di vista medico per garantire la massima precisione possibile.
Abbiamo linee guida rigorose in materia di sourcing e colleghiamo solo a siti di media affidabili, istituti di ricerca accademici e, ove possibile, studi rivisti dal punto di vista medico. Nota che i numeri tra parentesi ([1], [2], ecc.) Sono link cliccabili per questi studi.
Se ritieni che uno qualsiasi dei nostri contenuti sia impreciso, scaduto o comunque discutibile, selezionalo e premi Ctrl + Invio.
Con il termine "nanismo ipofisario" (dal greco nanos - nano; sin.: nanismo, nanosomia, microsomia) si intende in senso assoluto una malattia la cui principale manifestazione è un forte ritardo della crescita, associato a una violazione della secrezione dell'ormone della crescita da parte dell'ipofisi anteriore.
In senso più ampio, il nanismo è un disturbo della crescita e dello sviluppo fisico, la cui insorgenza può essere causata non solo da una carenza assoluta o relativa dell'ormone somatotropo dovuta a una patologia della ghiandola pituitaria stessa, ma anche da un disturbo della regolazione ipotalamica (cerebrale) delle sue funzioni, da difetti nella biosintesi dell'ormone somatotropo e da disturbi della sensibilità dei tessuti a questo ormone.
Le cause nanismo
La maggior parte delle forme di nanismo ipofisario sono malattie genetiche. La più comune è il nanismo panipopituitario, ereditato principalmente con modalità recessiva. Si presume che esistano due tipi di trasmissione di questa patologia: autosomica e attraverso il cromosoma X. In questa forma di nanismo, oltre al difetto nella secrezione dell'ormone somatotropo, la secrezione di gonadotropine e dell'ormone tireostimolante è più spesso compromessa. La secrezione di ACTH è compromessa meno frequentemente e in misura minore. Studi funzionali con ormoni di rilascio, incluso l'ormone di rilascio della somatotropina sintetico (costituito da 29, 40 e 44 residui aminoacidici), simile al polipeptide pancreatico, hanno dimostrato che la maggior parte di questi pazienti presenta una patologia a livello dell'ipotalamo e che l'insufficienza dell'ipofisi anteriore è secondaria. La patologia primaria dell'ipofisi stessa è meno comune.
Il nanismo genetico con deficit isolato dell'ormone della crescita, con alterata attività biologica e sensibilità ad esso, si riscontra sporadicamente in Russia e nei paesi limitrofi. È più comune nel continente americano, nei paesi del Vicino e Medio Oriente e in Africa. Sulla base dei risultati di uno studio sul contenuto ematico di ormone somatotropo e sulla sensibilità dei pazienti all'ormone somatotropo esogeno, sui livelli di insulina immunoreattiva (IRI), sui fattori di crescita insulino-simili (IGF) di tipo I (somatomedina C) e di tipo II, e sulla risposta dell'IGF-1 al trattamento con preparati di ormone somatotropo, sono state identificate diverse varianti di tipi di nanismo clinicamente simili.
Di recente è stata decifrata la patogenesi del nanismo di Laron, causato da una carenza di IRF-1 e IRF-II, nonché la patogenesi del nanismo nei pigmei africani, associato a una carenza dei primi.
Nel 1984 è stata descritta una nuova variante di nanismo pseudoipofisario con un alto livello di ormone somatotropo e IGF-1; la genesi del nanismo è spiegata da un difetto nei suoi recettori, dimostrato da una forte diminuzione del legame dei fibroblasti cutanei all'IGF-1.
Va sottolineato che nelle condizioni moderne, con la presenza di famiglie piccole, molti casi isolati (“idiopatici”, sporadici) della malattia possono essere anche genetici.
Nell'analisi di 350 anamnesi, l'eziologia del nanismo è risultata poco chiara in 228 pazienti (65,2%). Questo gruppo includeva pazienti provenienti da 57 famiglie con incidenza ripetuta di nanismo (2-4 casi per famiglia), che rappresentavano il 28% di tutti i pazienti. Nel 77% delle famiglie con forme di nanismo eziologicamente poco chiare (per lo più genetiche), è stata stabilita un'innegabile correlazione con l'ereditarietà dell'assenza del fattore Rh. La distribuzione del fattore Rh nelle famiglie di pazienti con nanismo differisce da quella osservata nel conflitto Rh tra madre e feto e, di norma, non è accompagnata da malattia emolitica del neonato (il padre può essere Rh negativo e, in caso di eterozigosi dei genitori per il fattore Rh, anche i figli, ecc.). È possibile ipotizzare una connessione tra l'attività dei geni responsabili della sintesi dell'ormone somatotropo (o ormone di rilascio della somatotropina) e i geni che determinano il fattore Rh, soprattutto perché la maggior parte delle forme di nanismo e l'assenza del fattore Rh sono caratteri autosomici recessivi. Ciò non spiega la relativa rarità del nanismo rispetto alla frequenza di individui Rh-negativi nella popolazione. Probabilmente, alcuni fattori aggiuntivi ancora sconosciuti sono importanti, ma è improbabile che le caratteristiche della distribuzione del fattore Rh nelle famiglie di pazienti con nanismo familiare e sporadico siano casuali.
Un ampio gruppo di pazienti con nanismo (cerebrale primario, cerebro-ipofisario) è costituito da pazienti con vari tipi di patologia organica del sistema nervoso centrale insorta in utero o nella prima infanzia. Il substrato anatomico che causa questa patologia può essere il sottosviluppo o l'assenza dell'ipofisi, la sua distopia nella patologia della formazione della sella turcica, la degenerazione cistica dell'ipofisi, la sua atrofia dovuta alla compressione da parte di un tumore (craniofaringioma, adenoma cromofobo, meningioma, glioma). Il nanismo può essere causato da lesioni traumatiche alla regione ipotalamo-ipofisaria (intrauterina, alla nascita o postnatale), che spesso si verificano nelle gravidanze multiple, così come durante il parto in presentazione podalica, di piede o in posizione trasversale con rotazione sulla gamba (questo è il meccanismo del parto in oltre 1/3 dei pazienti con nanismo). I danni infettivi e tossici sono importanti (infezioni virali intrauterine, tubercolosi, sifilide, malaria, toxoplasmosi; malattie in età precoce, sepsi neonatale, meningo- e aracnoencefalite, ecc.). Questi processi possono danneggiare la ghiandola pituitaria stessa, i centri ipotalamici che ne regolano la funzione e interrompere le normali connessioni funzionali nel sistema nervoso centrale.
Le lesioni fetali intrauterine possono portare alla nascita di pazienti affetti da “nanismo dalla nascita” con secrezione normale dell’ormone della crescita (nanismo primordiale cerebrale, microcefalia, nanismo di Silver-Russell con emi-asimmetria corporea e livelli elevati di gonadotropine, ecc.).
Ulteriori fattori che aggravano la violazione dello sviluppo fisico nel nanismo possono essere un'alimentazione inadeguata, sbilanciata in termini di ingredienti essenziali (carenza di proteine) e microelementi (carenza di zinco), e condizioni ambientali sfavorevoli, nonché varie malattie croniche, come la glomerulonefrite, in cui l'azotemia influisce sull'attività dei recettori epatici o influisce direttamente sul metabolismo delle cellule epatiche, causando una diminuzione della sintesi di somatomedina, o la cirrosi epatica, quando la formazione di somatomedina è compromessa.
Patogenesi
Nella maggior parte dei pazienti affetti da nanismo ipofisario, i cambiamenti non si limitano alla patologia della secrezione dell'ormone somatotropo e alla sensibilità ad esso, ma si estendono ad altri ormoni tropici della ghiandola pituitaria, il che causa varie combinazioni di disturbi endocrini e metabolici.
In caso di deficit isolato di ormone somatotropo, le alterazioni morfologiche dell'ipofisi sono state scarsamente studiate. Nei casi studiati, sono state raramente riscontrate patologie (craniofaringioma o iperostosi delle ossa craniche). In questo tipo di nanismo, si può osservare un sottosviluppo congenito delle cellule peptidergiche o un difetto del sistema neurotrasmettitoriale ipotalamico. In tali casi, il nanismo può essere associato a displasia o ipoplasia dei nervi ottici. Cisti intrasellari, tumori ipofisari e ipotalamici portano a deficit di STH, causando compressione del tessuto ipofisario, in particolare quello somatotropo.
Il nanismo è caratterizzato da un assottigliamento delle ossa, dovuto principalmente allo strato corticale, a un ritardo nella differenziazione e nell'ossificazione dello scheletro. Gli organi interni sono ipoplasici, talvolta atrofici, e i muscoli sono scarsamente sviluppati.
Sintomi nanismo
Un forte ritardo nella crescita e nello sviluppo fisico sono le principali manifestazioni del nanismo ipofisario. I pazienti nascono con peso e lunghezza corporei normali e iniziano a presentare un ritardo nella crescita a partire dall'età di 2-4 anni.
Prima dell'avvento del trattamento attivo per il nanismo, si consideravano nani coloro con un'altezza inferiore a 120 cm per le donne e 130 cm per gli uomini. Attualmente, l'altezza di un nano differisce di almeno 2-3 sigma dalla norma tabulare media per un dato sesso, età o popolazione. Esiste anche un metodo per la valutazione grafica dell'altezza basato sulla curva di distribuzione gaussiana. In questo caso, i nani in base all'altezza vengono inclusi in un gruppo che include il numero minimo di individui nella popolazione corrispondente con il maggiore ritardo rispetto alla norma di crescita media.
Il nanismo ipofisario è caratterizzato non solo da ridotte dimensioni corporee assolute, ma anche da una ridotta crescita annuale e da una ridotta dinamica di sviluppo fisico. La corporatura è proporzionata, ma le proporzioni corporee dei pazienti sono tipiche dell'infanzia. La pelle è pallida, spesso con una tinta giallastra, secca, dovuta a insufficienza tiroidea assoluta o relativa; a volte si osserva cianosi, ovvero una "marmorizzazione" della pelle. Nei pazienti non trattati, compare precocemente una pelle dall'aspetto invecchiato e rugoso (geroderma). Ciò è dovuto all'insufficienza dell'azione anabolica dell'STH e al lento ricambio delle generazioni cellulari.
I capelli sulla testa possono essere normali o secchi, sottili e fragili; le ciglia lunghe sono tipiche. La crescita secondaria dei peli è spesso assente. Le dimensioni della sella turcica nella maggior parte dei pazienti con nanismo (70-75%) non sono alterate, ma la sella spesso mantiene la forma infantile di un "ovale verticale", ha un dorso ampio e "giovanile", il seno sfenoide è in ritardo in termini di pneumatizzazione. Tuttavia, ci sono pazienti con una sella turcica ingrossata, segno di un tumore; con aree di calcificazione sul suo fondo o nella zona d'ingresso (con craniofaringioma, effetti residui di neuroinfezione) o la sua riduzione (segni di sottosviluppo, piccole dimensioni dell'ipofisi). Si osservano sintomi di ipertensione endocranica: assottigliamento delle ossa della volta cranica, aumento del pattern vascolare, presenza di impronte digitali, ecc. Il segno più importante del nanismo ipofisario è un ritardo nei tempi di differenziazione e ossificazione dello scheletro. Anche le caratteristiche del sistema dentale sono strettamente correlate alla differenziazione scheletrica: si nota una sostituzione tardiva dei denti da latte. Il ritardo maggiore nello sviluppo del sistema scheletrico si osserva nei pazienti affetti da nanismo con insufficienza sessuale e ipotiroidismo.
I genitali della maggior parte dei pazienti sono gravemente sottosviluppati, sebbene le malformazioni siano rare. Abbiamo osservato criptorchidismo nel 5,8% dei pazienti maschi. L'insufficienza sessuale è accompagnata da sottosviluppo dei caratteri sessuali secondari e diminuzione del desiderio sessuale, con assenza di mestruazioni. Uno sviluppo sessuale spontaneo normale si osserva solo nei pazienti con deficit isolato dell'ormone della crescita e in alcuni pazienti con nanismo cerebrale.
L'insufficienza tiroidea è un sintomo piuttosto comune di nanismo. È importante notare che le manifestazioni esterne dell'ipotiroidismo non sempre riflettono il reale stato funzionale della tiroide. Ciò è dovuto all'ipotiroidismo relativo, dovuto a un'alterazione della transizione da tiroxina (T4 ) a triiodotironina (T3 ) e alla formazione diT3 inattiva (reversibile), caratteristica dell'insufficienza somatotropa.
La funzione adrenocorticotropa nel nanismo ipofisario diminuisce meno frequentemente e in misura minore rispetto alle funzioni stimolanti la tiroide e il sesso e nella maggior parte dei pazienti non richiede una correzione speciale.
Nella maggior parte dei casi, l'intelletto non è compromesso. Si riscontrano alterazioni emotive sotto forma di infantilismo mentale; nei pazienti più anziani senza deficit intellettivo, si osservano talvolta nevrosi reattive.
Nella patologia cerebrale organica, soprattutto di natura tumorale, il nanismo può manifestarsi con sintomi di diabete insipido, emianopsia bitemporale e disabilità intellettiva.
Lo studio dello sviluppo dell'attività bioelettrica cerebrale in pazienti senza sintomi organici del sistema nervoso centrale ha mostrato che il loro EEG è caratterizzato da caratteristiche di immaturità, conservazione a lungo termine di un elevato voltaggio EEG "infantile"; irregolarità del ritmo alfa in ampiezza e frequenza; un forte aumento del contenuto di ritmi θ e δ lenti, soprattutto nelle derivazioni frontali e centrali; una chiara reazione all'iperventilazione; uno spostamento dell'intervallo dei ritmi EEG in seguito ai ritmi della stimolazione luminosa verso le basse frequenze (evidenza di una diminuzione della mobilità funzionale delle strutture nervose cerebrali). È stato rivelato che nei pazienti più anziani, la natura immatura dell'attività elettrica cerebrale è dovuta a sottosviluppo sessuale e, nei pazienti di tutte le fasce d'età, a ipotiroidismo.
Il metabolismo dei carboidrati nei pazienti con nanismo è caratterizzato da una tendenza alla diminuzione della glicemia a digiuno, un aumento durante lo sforzo fisico, un'insufficienza di insulina endogena e una maggiore sensibilità all'insulina esogena con frequente sviluppo di ipoglicemie. Quest'ultima è spiegata principalmente da livelli insufficienti di ormoni controinsulari nell'organismo dei pazienti.
Gli organi interni mostrano splancnomicria, ovvero una riduzione delle loro dimensioni. Non sono state descritte alterazioni funzionali degli organi interni specifiche del nanismo. Si osserva spesso ipotensione arteriosa con riduzione della pressione sistolica e diastolica e riduzione dell'ampiezza del polso. I toni cardiaci sono ovattati, si udiranno soffi funzionali di vario tipo dovuti ad alterazioni trofiche del miocardio e a disturbi autonomici. L'ECG è caratterizzato da basso voltaggio (specialmente in presenza di ipotiroidismo), bradicardia sinusale o bradiaritmia; la PCG mostra una riduzione dell'ampiezza dei toni, toni addizionali e soffi funzionali. I dati dell'ossigemometria indicano ipossiemia (iniziale e durante lo sforzo fisico) e debito di ossigeno. I pazienti anziani talvolta sviluppano ipertensione.
Diagnostica nanismo
La diagnosi e la diagnosi differenziale del nanismo si basano sui dati anamnestici e su un esame clinico, radiologico, di laboratorio e ormonale completo. Oltre alle dimensioni corporee assolute, per valutare la crescita dei pazienti si determina il deficit di crescita: la differenza tra l'altezza del paziente e la sua norma media per sesso ed età corrispondenti; l'età di crescita: la conformità dell'altezza del paziente a determinati standard; l'indicatore di deviazione normalizzata.
I = M - Mcp / δ, dove M è l'altezza del paziente, Mcp è l'altezza media normale per un dato sesso ed età, δ è la deviazione quadratica da Mcp; I inferiore a 3 è tipico del nanismo, I superiore a 3 è tipico del gigantismo. Questo indicatore può essere utilizzato per valutare le dinamiche dello sviluppo.
L'esame radiografico dei pazienti con nanismo rivela segni di ipertensione intracranica, effetti residui di neuroinfezione, calcificazioni e craniosinostosi. Lo studio delle dimensioni, della forma e della struttura della sella turcica è considerato un indicatore indiretto che caratterizza le dimensioni dell'ipofisi. Una delle manifestazioni più importanti del ritardo di crescita patologico è una compromissione della differenziazione scheletrica. Per valutare il grado di maturità scheletrica, si determina l'età ossea (radiografica), che corrisponde alla differenziazione del tessuto osseo; il deficit di ossificazione è il grado di ritardo dell'ossificazione rispetto alla norma (in anni), mentre il coefficiente di ossificazione è il quoziente ottenuto dividendo l'età ossea per parametri cronologici e altri.
La moderna diagnosi di nanismo è impossibile senza studiare la secrezione dell'ormone somatotropo, il suo livello basale, il ritmo circadiano e il rilascio sotto stimolazione. La maggior parte dei pazienti con nanismo ipofisario è caratterizzata da un ridotto contenuto di ormone somatotropo nel siero sanguigno. Determinato con metodo radioimmunologico, il suo valore è (secondo diversi autori) compreso tra (0,87±0,09) e (1,50±0,64) ng/ml, con un valore medio normale di (3,81±0,29) ng/ml. Uno studio sui ritmi giornalieri (circadiani) della secrezione dell'ormone somatotropo ha dimostrato che il suo livello nelle persone sane è massimo durante le prime 2 ore di sonno e tra le 4 e le 6 del mattino. Nel nanismo, il contenuto di ormone somatotropo è ridotto anche in queste ore.
Per studiare le riserve della funzione somatotropa, vengono utilizzati diversi stimolanti, esaminando il contenuto di ormone somatotropo prima e dopo la loro somministrazione. Il sangue per lo studio viene prelevato ogni 30 minuti per 2-3 ore. Il rilascio di ormone somatotropo dopo stimolazione è considerato normale almeno fino a 7-10 ng/ml, talvolta raggiungendo 20-40 ng/ml. Se non si osserva alcuna reazione in uno dei campioni, vengono eseguiti test ripetuti con altri stimolanti. L'insufficienza di ormone somatotropo è considerata dimostrata in assenza di rilascio di ormone somatotropo in 2-3 campioni diversi.
I test di stimolazione più comunemente utilizzati sono: con somministrazione endovenosa di 0,1 U (0,75-1,5 U) di insulina per 1 kg di peso corporeo del paziente e al raggiungimento dell'ipoglicemia (una riduzione del livello di glucosio nel sangue del 50% rispetto al livello iniziale), l'ormone somatotropo sierico viene determinato secondo lo schema sopra descritto. In caso di ipoglicemia grave, il test viene interrotto e al paziente viene somministrato glucosio per via endovenosa. Questo è il metodo diagnostico classico più comune.
TRH in una dose di 200-500 mcg per via endovenosa. Identifica efficacemente le riserve ormonali, non causa complicazioni. In combinazione con il test dell'insulina, permette di valutare il livello di danno al sistema ipotalamo-ipofisario. Una reazione positiva al TRH in assenza di ipoglicemia insulinica indica l'integrità dell'ipofisi e un danno a livello ipotalamico, mentre reazioni negative al TRH e all'ipoglicemia indicano un danno all'ipofisi stessa.
TRH, LH-RH alla dose di 300 mcg per via endovenosa è simile al precedente.
L'SGH umano è un analogo sintetico di un composto biologicamente attivo isolato da un tumore pancreatico. Attualmente, esistono 3 tipi di SGH sintetico: con 29, 40 e 44 residui aminoacidici. Viene utilizzato per via endovenosa in dosi da 1 a 3 μg/kg di peso corporeo del paziente. Il rilascio di STH si osserva 15-20 minuti dopo la somministrazione; il test è più efficace di altri nel rivelare le riserve di ormone della crescita endogeno. Una reazione positiva all'SGH indica un danno ipotalamico alla funzione somatotropa e un'ipofisi intatta; con aminoacidi (L-arginina monocloruro, ornitina, triptofano, glicina, leucina) per via endovenosa alla dose di 0,25-0,5 g per 1 kg di peso corporeo del paziente. Efficace per lo studio delle riserve di SGH. Può causare reazioni allergiche.
L-dopa per via orale alla dose di 250-500 mcg. Efficace, ben tollerata dai pazienti.
Vengono utilizzati anche test con glucagone, bromo ergocriptina (parlodel), lisina vasopressina, clonidina e carico cicloergometrico dosato.
Lo studio dello stato della funzione somatotropa è necessario non solo per la diagnosi di nanismo, ma anche per la scelta giustificata di un metodo terapeutico, poiché il trattamento con somatotropina è razionale solo in caso di insufficienza dell'ormone della crescita endogeno.
Per la diagnosi della forma di nanismo, è fondamentale studiare il contenuto di fattori di crescita insulino-simili, o somatomedine (in particolare IGF-1 o somatomedina C), mediatori dell'azione dell'ormone somatotropo a livello tissutale. È noto che il contenuto di somatomedina C nel nanismo è ridotto, mentre nell'acromegalia è aumentato rispetto alla norma. La forma di nanismo descritta da Laron è una malattia con normale produzione di STH, ma con una compromissione della formazione di IGF-1 e IGF-II. Il trattamento di questi pazienti con somatotropina è inutile.
Indicatori indiretti della funzione somatotropa dell'ipofisi sono l'attività della fosfatasi alcalina e il contenuto di fosforo inorganico nel siero. In condizioni iposomatotrope, questi indicatori sono ridotti. Nella forma panipopituitaria di nanismo, la secrezione di gonadotropine, spesso TSH, è ridotta, il che è accompagnato da una corrispondente diminuzione delle funzioni delle ghiandole sessuali (carenza di androgeni o estrogeni), della tiroide (diminuzione dei livelli di T3 , T4 , iodio legato alle proteine - PBI, accumulo di 131 I da parte della tiroide) e delle ghiandole surrenali (diminuzione della quantità di cortisolo e 17-OCS nel plasma, escrezione di 17-KC e 17-OCS nelle urine, linfocitosi).
Tutti i tipi di nanismo genetico ipofisario (ipotalamo-ipofisario) sono caratterizzati da ripetuti episodi di malattia nei bambini di una famiglia con trasmissione autosomica recessiva (più spesso) o autosomica dominante, ritardo di crescita e sviluppo fisico dai 2 ai 4 anni con un ritardo di almeno 2-3 gradi rispetto ai valori medi di crescita per un dato sesso, età, popolazione, con bassa dinamica di crescita spontanea annuale e ossificazione ritardata. Con un basso livello di ormone somatotropo (in 2-3 test stimolanti inferiori a 7 ng/ml), la terapia con ormone somatotropo è altamente efficace (consente un aumento di altezza di almeno 7 cm all'anno). Con un livello di ormone somatotropo normale o elevato (con la sua inattività biologica), la sensibilità all'ormone può essere preservata. Non si osservano alterazioni dell'intelligenza.
Nel nanismo genetico con insensibilità tissutale all'ormone somatotropo, il quadro clinico è simile a quello del deficit isolato dell'ormone della crescita, ma la terapia con somatotropina è inefficace. In questo gruppo, si possono distinguere le seguenti forme principali in base al livello di IRF: con contenuto normale (difetto del recettore IRF) e ridotto - nanismo tipo Laron (deficit di IRF-1 e IRF-II) e tipo riscontrato nei pigmei africani (deficit di IRF-1).
Il nanismo cerebrale è caratterizzato da malattie isolate in una famiglia associate a danni intrauterini o postnatali al sistema nervoso centrale, con presenza di evidenti alterazioni organiche nel sistema nervoso centrale, spesso associate a patologia dell'organo visivo, presenza di diabete insipido, conservazione delle funzioni gonadotropiche e alterazioni dell'intelligenza.
Alcuni tipi di disgenesia gonadica e agenesia sono accompagnati da una marcata bassa statura, in particolare la sindrome di Shereshevsky-Turner e la forma "Turneroide" (a mosaico) della sindrome da disgenesia testicolare. Gli studi citogenetici (cromatina sessuale, cariotipo) aiutano nella diagnosi differenziale, rivelando difetti cromosomici, così come difetti caratteristici dello sviluppo somatico e sessuale, livelli normali o elevati di ormone somatotropo endogeno e insensibilità al trattamento con somatotropina.
Tra i disturbi endocrini che si verificano con bassa statura, va evidenziato l'ipotiroidismo primario, causato da ipoplasia o aplasia congenita della tiroide, dalla sua distopia, da difetti enzimatici nella biosintesi degli ormoni tiroidei e da danno autoimmune precoce alla tiroide. In tutte queste condizioni, dominano i segni di ipotiroidismo con un livello elevato di TSH e una diminuzione di T4 e T3 nel siero sanguigno. Nel mixedema di genesi autoimmune, nel sangue vengono rilevati anticorpi contro la tireoglobulina, le frazioni microsomiali e nucleari del tessuto tiroideo, mentre il livello di ormone somatotropo è normale o ridotto. L'effetto clinico può essere ottenuto compensando solo l'ipotiroidismo.
La bassa statura è accompagnata da sviluppo sessuale prematuro e sindrome adrenogenitale dovuta alla chiusura precoce delle zone di crescita; malattia di Itsenko-Cushing, che si manifesta durante l'infanzia a causa dell'effetto inibitorio dei glucocorticoidi sulla secrezione dell'ormone somatotropo e sul loro effetto catabolico; sindrome di Mauriac: bassa statura e infantilismo dei pazienti con diabete mellito insulino-dipendente grave.
Il nanismo ipofisario deve essere differenziato dal ritardo somatogeno dello sviluppo fisico causato da disturbi metabolici cronici (nelle malattie del fegato, dei reni, del tratto gastrointestinale), dall'ipossia cronica (nelle malattie dell'apparato cardiovascolare e respiratorio, nell'anemia); dalle malattie sistemiche dell'apparato muscolo-scheletrico (condrodistrofia, osteogenesi imperfetta, malattia da esostosi), ecc.
Un ritardo della crescita funzionale (costituzionale) si osserva talvolta con l'esordio tardivo della pubertà in adolescenti apparentemente sani; abbiamo scoperto che è principalmente associato a un'insufficienza transitoria dell'attività gonadotropa. La secrezione dell'ormone somatotropo di solito non è compromessa o è leggermente ridotta. La stimolazione delle gonadotropine può accelerare sia lo sviluppo sessuale che la crescita.
La bassa statura di natura familiare dovrebbe essere considerata una variante dello sviluppo fisiologico.
Come esaminare?
Quali test sono necessari?
Chi contattare?
Trattamento nanismo
Il trattamento del nanismo è un processo lungo. Questo obbliga il medico a distribuire nel tempo i mezzi per influenzare la crescita al fine di ottenere il massimo effetto clinico, rispettando 2 principi fondamentali:
- massima approssimazione dello sviluppo indotto dal trattamento alle condizioni fisiologiche;
- risparmiando le zone di crescita epifisaria.
La pluriennale esperienza nel trattamento del nanismo ci consente di considerare appropriato il seguente schema di terapia a stadi. La diagnosi di nanismo nei pazienti adulti di solito non solleva dubbi. Nei bambini piccoli, se il quadro clinico non è chiaro, è necessario un periodo di diagnosi: 6-12 mesi di osservazione senza terapia ormonale. Durante questo periodo, viene prescritto un trattamento di rafforzamento generale complesso: un'alimentazione adeguata con un aumento del contenuto di proteine animali, verdura e frutta nella dieta, vitamine A e D, preparati di calcio e fosforo. L'assenza di sufficienti cambiamenti nella crescita e nello sviluppo fisico in questo contesto e l'individuazione di disturbi endocrini durante l'esame costituiscono la base per l'inizio della terapia ormonale.
Il principale tipo di terapia patogenetica per il nanismo ipofisario è l'uso dell'ormone della crescita umano, poiché l'insorgenza della maggior parte dei casi di nanismo dipende indubbiamente dall'una o dall'altra forma di carenza. A causa della specificità di specie di questo ormone, solo la somatotropina umana e dei primati è attiva per l'uomo. Un farmaco isolato dall'ipofisi di persone decedute per malattie non infettive e non neoplastiche è ampiamente utilizzato in clinica. La somatotropina umana si ottiene per sintesi batterica utilizzando Escherichia coli mediante ingegneria genetica. La somatotropina umana viene anche sintetizzata chimicamente, ma è estremamente costosa e non viene praticamente utilizzata in clinica. I pazienti con comprovata carenza di ormone della crescita endogeno, con differenziazione scheletrica non superiore al livello tipico di 13-14 anni, vengono selezionati per il trattamento con somatotropina. Non ci sono limiti di età per il trattamento.
Le dosi minime efficaci utilizzabili nel primo periodo di trattamento sono 0,03-0,06 mg/kg di peso corporeo. Le dosi più efficaci sono 2-4 mg 3 volte a settimana. L'aumento della dose singola a 10 mg non si è accompagnato a un adeguato aumento dell'effetto sulla crescita, ma ha causato una rapida formazione di anticorpi anti-somatotropina.
Nel nostro Paese, lo studio dell'ormone della crescita umano è stato condotto fin dal 1960. Sono stati testati due regimi di trattamento: continuo e intermittente, con cicli di 2-3 mesi e intervalli di tempo costanti tra di essi. L'aumento medio dell'altezza dei pazienti durante il primo anno di trattamento è stato di 9,52±0,39 cm, l'aumento del peso corporeo di 4,4±0,14 kg. Con il trattamento continuo a lungo termine, l'aumento medio dell'altezza è stato di 0,82 cm/mese, il peso corporeo di 0,38 kg/mese; con il trattamento intermittente di 0,75 cm/mese e 0,4 kg/mese, rispettivamente. Il trattamento continuo ha prodotto un aumento dell'altezza più rapido con una netta diminuzione dell'effetto dopo 1-1,5 anni, mentre con il trattamento intermittente l'efficacia si è mantenuta per 3-4 anni, il che ci consente di considerare il regime di trattamento più appropriato. La determinazione del livello di IGF-I (somatomedina C) può fungere da indicatore affidabile della sensibilità del paziente al trattamento con farmaci somatotropinici. Un aumento del contenuto di IGF-I dopo l'introduzione dell'ormone somatotropo consente di prevedere un effetto positivo della terapia. Un importante vantaggio del trattamento con somatotropina è l'assenza di accelerazione dell'ossificazione scheletrica rispetto al suo contesto.
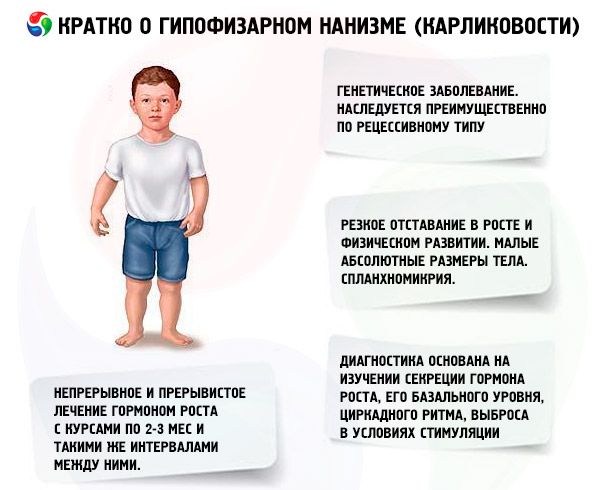
Il trattamento più importante per il nanismo è l'uso di steroidi anabolizzanti, che stimolano la crescita migliorando la sintesi proteica e aumentando i livelli di ormone somatotropo endogeno. Il trattamento viene effettuato per diversi anni, con una graduale sostituzione di alcuni farmaci con altri, da composti meno attivi a composti più attivi. Un cambio di farmaci anabolizzanti è indicato quando l'effetto sulla crescita diminuisce dopo 2-3 anni, il che porta a un ulteriore aumento della crescita. Il trattamento viene effettuato a cicli (il periodo di riposo dovrebbe essere pari alla metà del periodo di trattamento). In caso di dipendenza, sono indicate anche pause più lunghe (fino a 4-6 mesi). Viene prescritto un solo steroide anabolizzante alla volta. La combinazione di 2 o più farmaci è inappropriata, poiché ciò non ne potenzia gli effetti metabolici e sulla crescita. Quest'ultimo dipende principalmente dall'età dei pazienti e dal grado di differenziazione delle ossa scheletriche all'inizio del trattamento. L'effetto migliore si osserva nei pazienti di età inferiore ai 16-18 anni con ossificazione scheletrica non superiore al livello caratteristico di un quattordicenne. Si consiglia di iniziare il trattamento immediatamente dopo la diagnosi, di solito a partire dai 5-7 anni. Prima del trattamento, è necessario evitare la prescrizione di gonadotropine e ormoni sessuali, che, stimolando la crescita, accelerano contemporaneamente la differenziazione scheletrica. Il principio di dosaggio degli steroidi anabolizzanti va dalle dosi minime efficaci a quelle gradualmente crescenti. Le dosi raccomandate dei farmaci più comuni sono: nerobol (metandrostenolo, dianabol) - 0,1-0,15 mg per 1 kg di peso corporeo al giorno per via orale; nerobolil (durabolin) - 1 mg per 1 kg di peso corporeo al mese per via intramuscolare, la dose mensile viene somministrata in 2-3 dosi, rispettivamente, dopo 15 o 10 giorni; Retabolil (Deca-Durabolin) - 1 mg per 1 kg di peso corporeo una volta al mese per via intramuscolare. Il superamento delle dosi indicate può portare ad androgenizzazione. A dosi fisiologiche, questi composti non influenzano significativamente la condizione dei genitali e la differenziazione delle ossa scheletriche, il che ne consente l'uso a lungo termine in pazienti di entrambi i sessi. Le ragazze devono essere sottoposte a supervisione ginecologica, poiché in caso di sovradosaggio o aumentata sensibilità individuale, alcune pazienti possono sviluppare segni di virilizzazione, che regrediscono rapidamente con l'interruzione del trattamento. I farmaci orali metilati in etilati in posizione 17 possono talvolta causare un effetto colestatico, pertanto, in caso di malattie epatiche, si dovrebbe dare preferenza ai composti anabolizzanti parenterali oppure i farmaci orali dovrebbero essere combinati con agenti coleretici. Molto raramente, il trattamento con steroidi anabolizzanti può causare reazioni allergiche (prurito, eruzioni cutanee). In assenza di complicazioni, gli steroidi anabolizzanti vengono utilizzati finché si osserva l'effetto di crescita (fino a 16-18 anni, e talvolta anche oltre). Il trattamento viene effettuato nel contesto di una terapia di rafforzamento generale.
Se i pazienti presentano segni di ipotiroidismo, vengono prescritti contemporaneamente farmaci per la tiroide (tiroxina, thyroidin, tireotom) in dosi selezionate individualmente.
Nel trattamento dei ragazzi, il passo successivo è la somministrazione di gonadotropina corionica umana. Questo farmaco viene utilizzato non prima dei 15-16 anni, e spesso anche in età più avanzata, per stimolare le cellule di Leydig, accelerando sia lo sviluppo sessuale che la crescita (grazie all'attività anabolica dei loro stessi androgeni). Dosi da 1000 a 1500 UI vengono utilizzate 1-2 volte a settimana per via intramuscolare in cicli di 2 mesi, non più di 2-3 volte all'anno. Se l'effetto non è completo, il trattamento con gonadotropina corionica umana nei ragazzi dai 16 anni in su viene alternato alla somministrazione di piccole dosi di androgeni (metiltestosterone alla dose di 5-10 mg/die per via sublinguale).
Le ragazze di età superiore ai 16 anni possono iniziare il trattamento con piccole dosi di estrogeni, simulando un normale ciclo sessuale. Il trattamento viene effettuato per 3 settimane al mese, seguite da una pausa. Nella seconda fase del ciclo, a partire dalla terza settimana, può essere prescritta gonadotropina corionica umana alla dose di 1000-1500 UI 3-5 volte a settimana o farmaci con effetto gestageno (pregnina, progesterone).
La fase finale del trattamento (dopo la chiusura delle zone di crescita) consiste nella somministrazione costante di dosi terapeutiche di ormoni sessuali corrispondenti al sesso del paziente, al fine di favorire il completo sviluppo dei genitali e dei caratteri sessuali secondari, garantire la libido e la potenza sessuale. I preparati combinati estroprogestinici (non-ovlon, bisecurina, infekundin, rigevidon) sono indicati per il trattamento delle pazienti di sesso femminile, mentre i preparati androgeni a rilascio prolungato (testenato, sustanon-250, omnadren-250) sono indicati per il trattamento dei pazienti di sesso maschile.
Si esegue un trattamento di rafforzamento generale (regime, dieta proteico-vegetativa, terapia vitaminica, biostimolanti). È indicato l'uso di preparati a base di zinco, il cui meccanismo d'azione è principalmente basato sull'aumento dell'attività dell'IGF-1 (fattore di crescita insulino-simile I).
In presenza di patologia organica del sistema nervoso centrale, vengono somministrate terapie antinfiammatorie, di riassorbimento e di disidratazione. La terapia sistematica mirata offre un effetto incoraggiante. Come risultato del trattamento a fasi a lungo termine, 148 (80,4%) di 175 pazienti affetti da nanismo di entrambi i sessi sono riusciti a raggiungere un'altezza superiore a 130 cm, 92 (52,5%) superiore a 140 cm e 32 (18,3%) pari o superiore a 150-160 cm. Allo stesso tempo, 37 pazienti (21,2%) hanno aumentato la propria altezza di 30 cm, 107 (61,1%) di 31-50 cm e 31 (17,7%) di 51-60 cm o superiore.
Previsione
La prognosi dipende dalla forma di nanismo. Nelle forme genetiche di nanismo, la prognosi per la vita è favorevole. In presenza di un tumore ipofisario e di danni organici al sistema nervoso centrale, la prognosi è determinata dalla dinamica dello sviluppo del processo patologico principale. I moderni metodi terapeutici hanno aumentato significativamente le capacità fisiche e lavorative dei pazienti, prolungandone l'aspettativa di vita. Durante il periodo di trattamento attivo, i pazienti devono sottoporsi a visita medica ogni 2-3 mesi, con terapia di mantenimento ogni 6-12 mesi.
Per il loro adattamento sociale è di fondamentale importanza che i pazienti trovino un impiego che corrisponda alle loro capacità intellettuali e fisiche.
È consigliabile scegliere professioni che non comportino un grande sforzo fisico, ma che consentano di dimostrare capacità intellettuali, capacità di svolgere lavori di precisione e conoscenze linguistiche.


 [
[