Esperto medico dell'articolo
Nuove pubblicazioni
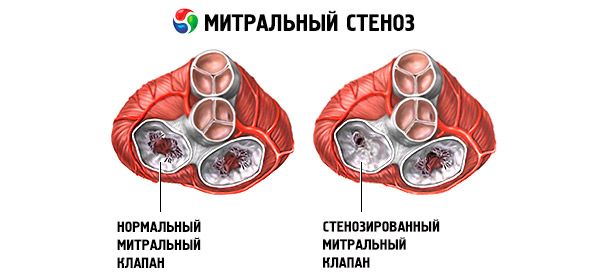
Stenosi mitralica
Ultima recensione: 04.07.2025

Tutti i contenuti di iLive sono revisionati o verificati da un punto di vista medico per garantire la massima precisione possibile.
Abbiamo linee guida rigorose in materia di sourcing e colleghiamo solo a siti di media affidabili, istituti di ricerca accademici e, ove possibile, studi rivisti dal punto di vista medico. Nota che i numeri tra parentesi ([1], [2], ecc.) Sono link cliccabili per questi studi.
Se ritieni che uno qualsiasi dei nostri contenuti sia impreciso, scaduto o comunque discutibile, selezionalo e premi Ctrl + Invio.
La stenosi mitralica è un restringimento dell'orifizio mitralico che impedisce il flusso sanguigno dall'atrio sinistro al ventricolo sinistro. La causa più comune è la febbre reumatica. I sintomi sono gli stessi dello scompenso cardiaco. Il tono di apertura e il soffio diastolico sono oggettivamente rilevabili. La diagnosi viene stabilita mediante esame obiettivo ed ecocardiografia. La prognosi è favorevole. Il trattamento farmacologico della stenosi mitralica include diuretici, beta-bloccanti o calcioantagonisti che riducono la frequenza cardiaca e anticoagulanti. Il trattamento chirurgico dei casi più gravi di stenosi mitralica consiste nella valvulotomia con palloncino, nella commissurotomia o nella sostituzione valvolare.
Epidemiologia
Quasi sempre, la stenosi mitralica è una conseguenza della febbre reumatica acuta. L'incidenza varia significativamente: nei paesi sviluppati si osservano 1-2 casi ogni 100.000 abitanti, mentre nei paesi in via di sviluppo (ad esempio, in India), i difetti reumatici della valvola mitrale si osservano in 100-150 casi ogni 100.000 abitanti.
Le cause stenosi mitralica
La stenosi mitralica è quasi sempre una conseguenza della febbre reumatica acuta (RF). La stenosi mitralica isolata, "pura", si verifica nel 40% dei casi tra tutti i pazienti con cardiopatia reumatica; in altri casi, è associata a insufficienza e danno ad altre valvole. Cause rare di stenosi mitralica includono malattie reumatiche (artrite reumatoide, lupus eritematoso sistemico) e calcificazione dell'anello mitralico.
Patogenesi
Nella stenosi mitralica reumatica, si osserva compattazione, fibrosi e calcificazione delle cuspidi valvolari, fusione lungo le commissure con frequente coinvolgimento delle corde. Normalmente, l'area dell'orifizio mitralico è di 4-6 cm² e la pressione nell'atrio sinistro non supera i 5 mm Hg. Quando l'orifizio atrioventricolare sinistro si restringe a 2,5 cm² , si crea un ostacolo al normale flusso sanguigno dall'atrio sinistro al ventricolo sinistro e il gradiente pressorio valvolare inizia ad aumentare. Di conseguenza, la pressione nell'atrio sinistro aumenta fino a 20-25 mm Hg. Il gradiente pressorio risultante tra l'atrio sinistro e il ventricolo sinistro favorisce il movimento del sangue attraverso l'orifizio ristretto.
Con il progredire della stenosi, il gradiente pressorio transmitrale aumenta, contribuendo a mantenere il flusso sanguigno diastolico attraverso la valvola. Secondo la formula di Gorlin, l'area della valvola mitrale (5MC) è determinata dai valori del gradiente transmitrale (MG) e del flusso sanguigno mitralico (MBF):
BMK - MK/37.7 • ∆DM
La principale conseguenza emodinamica dei difetti della valvola mitrale è la congestione del circolo polmonare (CP). Con un moderato aumento della pressione nell'atrio sinistro (non superiore a 25-30 mmHg), il flusso sanguigno nel PC viene ostacolato. La pressione nelle vene polmonari aumenta e viene trasmessa attraverso i capillari all'arteria polmonare, con conseguente sviluppo di ipertensione polmonare venosa (o passiva). Con un aumento della pressione nell'atrio sinistro superiore a 25-30 mmHg, aumenta il rischio di rottura dei capillari polmonari e di sviluppo di edema polmonare alveolare. Per prevenire queste complicanze, si verifica uno spasmo riflesso protettivo delle arteriole polmonari. Di conseguenza, il flusso sanguigno dal ventricolo destro ai capillari cellulari diminuisce, ma la pressione nell'arteria polmonare aumenta bruscamente (si sviluppa ipertensione polmonare arteriosa, o attiva).
Nelle fasi iniziali della malattia, la pressione nell'arteria polmonare aumenta solo durante lo stress fisico o emotivo, quando il flusso sanguigno nell'ICC dovrebbe aumentare. Le fasi avanzate della malattia sono caratterizzate da elevati valori di pressione nell'arteria polmonare anche a riposo e da un aumento ancora maggiore sotto stress. La presenza a lungo termine di ipertensione polmonare è accompagnata dallo sviluppo di processi proliferativi e sclerotici nella parete delle arteriole dell'ICC, che gradualmente si obliterano. Nonostante il fatto che la comparsa di ipertensione polmonare arteriosa possa essere considerata un meccanismo compensatorio, a causa della diminuzione del flusso sanguigno capillare, anche la capacità di diffusione polmonare diminuisce drasticamente, soprattutto sotto stress, ovvero viene attivato il meccanismo di progressione dell'ipertensione polmonare dovuta all'ipossiemia. L'ipossia alveolare causa vasocostrizione polmonare attraverso meccanismi diretti e indiretti. L'effetto diretto dell'ipossia è associato alla depolarizzazione delle cellule muscolari lisce vascolari (mediata da un'alterazione della funzione dei canali del potassio nelle membrane cellulari) e alla loro contrazione. Il meccanismo indiretto coinvolge l'azione di mediatori endogeni (come leucotrieni, istamina, serotonina, angiotensina II e catecolamine) sulla parete vascolare. L'ipossiemia cronica porta a disfunzione endoteliale, che è accompagnata da una diminuzione della produzione di fattori rilassanti endogeni, tra cui prostaciclina, prostaglandina E2 e ossido nitrico. La disfunzione endoteliale a lungo termine porta all'obliterazione dei vasi polmonari e al danno endoteliale, che a sua volta porta a un aumento della coagulazione del sangue, alla proliferazione delle cellule muscolari lisce con una tendenza alla formazione di trombi in situ e a un aumento del rischio di complicanze trombotiche con lo sviluppo di successiva ipertensione polmonare posttrombotica cronica.
Le cause dell'ipertensione polmonare nei difetti della valvola mitrale, inclusa la stenosi mitralica, sono:
- trasmissione passiva della pressione dall'atrio sinistro al sistema venoso polmonare;
- spasmo delle arteriole polmonari in risposta all'aumento della pressione nelle vene polmonari;
- gonfiore delle pareti dei piccoli vasi polmonari;
- obliterazione dei vasi polmonari con danno endoteliale.
Il meccanismo di progressione della stenosi mitralica rimane tutt'oggi poco chiaro. Diversi autori ritengono che il fattore principale sia la valvulite in atto (spesso subclinica), mentre altri attribuiscono il ruolo principale alla traumatizzazione delle strutture valvolari causata dal flusso sanguigno turbolento con masse trombotiche depositate sulle valvole, che è alla base del restringimento dell'orifizio mitralico.
Sintomi stenosi mitralica
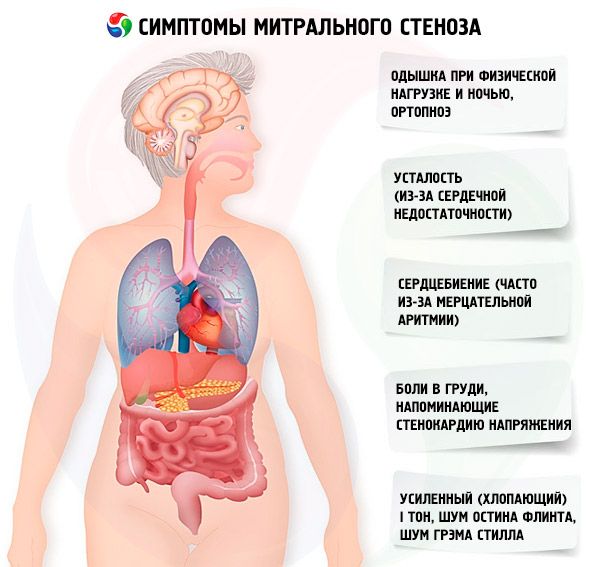
I sintomi della stenosi mitralica sono scarsamente correlati alla gravità della malattia, poiché nella maggior parte dei casi la patologia progredisce lentamente e i pazienti riducono la loro attività senza accorgersene. Molti pazienti non presentano manifestazioni cliniche fino alla gravidanza o allo sviluppo della fibrillazione atriale. I sintomi iniziali sono solitamente quelli dello scompenso cardiaco (dispnea da sforzo, ortopnea, dispnea parossistica notturna, affaticamento). Di solito compaiono 15-40 anni dopo l'episodio di febbre reumatica, ma nei paesi in via di sviluppo i sintomi possono comparire anche nei bambini. La fibrillazione atriale parossistica o persistente peggiora la disfunzione diastolica preesistente, causando edema polmonare e dispnea acuta se la frequenza ventricolare è scarsamente controllata.
La fibrillazione atriale può manifestarsi anche con palpitazioni; nel 15% dei pazienti non trattati con anticoagulanti, ciò provoca embolia sistemica con ischemia degli arti o ictus.
Sintomi meno comuni includono emottisi dovuta alla rottura di piccoli vasi polmonari ed edema polmonare (specialmente durante la gravidanza quando aumenta il volume del sangue); disfonia dovuta alla compressione del nervo laringeo ricorrente sinistro da parte di un atrio sinistro dilatato o di un'arteria polmonare (sindrome di Ortner); sintomi di ipertensione arteriosa polmonare e insufficienza ventricolare destra.
I primi sintomi della stenosi mitralica
Con un'area dell'orifizio mitralico >1,5 cm² , i sintomi possono essere assenti, ma un aumento del flusso ematico transmitralico o una riduzione del tempo di riempimento diastolico portano a un brusco aumento della pressione nell'atrio sinistro e alla comparsa di sintomi. Fattori scatenanti dello scompenso: sforzo fisico, stress emotivo, fibrillazione atriale, gravidanza.
Il primo sintomo di stenosi mitralica (in circa il 20% dei casi) può essere un evento embolico, il più delle volte un ictus con sviluppo di deficit neurologico persistente nel 30-40% dei pazienti. Un terzo delle tromboembolie si sviluppa entro 1 mese dall'insorgenza della fibrillazione atriale, due terzi entro il primo anno. La fonte dell'embolia è solitamente rappresentata da trombi localizzati nell'atrio sinistro, in particolare nella sua appendice. Oltre agli ictus, sono possibili embolie a carico di milza, reni e arterie periferiche.
Nel ritmo sinusale, il rischio di embolia è determinato da:
- età;
- trombosi atriale sinistra;
- area dell'orifizio mitrale;
- insufficienza aortica concomitante.
In caso di fibrillazione atriale permanente, il rischio di embolia aumenta significativamente, soprattutto se il paziente ha una storia di complicanze simili. Anche l'enhancement spontaneo del contrasto nell'atrio sinistro durante l'ecocardiografia transesofagea è considerato un fattore di rischio per l'embolia sistemica.
Con un aumento della pressione nella ICC (specialmente nella fase di ipertensione polmonare passiva), compaiono lamentele di dispnea durante lo sforzo fisico. Con il progredire della stenosi, la dispnea si verifica anche con carichi minori. È importante ricordare che la dispnea può essere assente anche in caso di ipertensione polmonare conclamata, poiché il paziente potrebbe condurre uno stile di vita sedentario o limitare inconsciamente l'attività fisica quotidiana. La dispnea parossistica notturna si verifica a causa del ristagno di sangue nella ICC quando il paziente è sdraiato, come manifestazione di edema polmonare interstiziale e di un forte aumento della pressione sanguigna nei vasi della ICC. A causa dell'aumento della pressione nei capillari polmonari e dell'essudazione di plasma ed eritrociti nel lume degli alveoli, può svilupparsi emottisi.
I pazienti lamentano spesso un aumento dell'affaticamento, palpitazioni e battito cardiaco irregolare. Si può osservare anche una raucedine transitoria (sindrome di Ortner). Questa sindrome si verifica a causa della compressione del nervo ricorrente da parte dell'atrio sinistro dilatato.
I pazienti con stenosi mitralica spesso avvertono dolori toracici simili all'angina. Le cause più probabili sono l'ipertensione polmonare e l'ipertrofia ventricolare destra.
In caso di grave scompenso, si possono osservare facies mitralis (un rossore bluastro-rosato sulle guance associato a frazione di eiezione ridotta, vasocostrizione sistemica e insufficienza cardiaca destra), pulsazione epigastrica e segni di insufficienza cardiaca ventricolare destra.
 [ 21 ]
[ 21 ]
Ispezione e auscultazione
All'ispezione e alla palpazione, si possono rilevare distinti toni cardiaci I (S1) e II (S2). S1 è meglio palpabile all'apice e S2 al margine sternale superiore sinistro. La componente polmonare di S3 (P) è responsabile dell'impulso ed è conseguenza dell'ipertensione arteriosa polmonare. Una pulsazione del ventricolo destro visibile, palpabile al margine sternale sinistro, può accompagnare la distensione venosa giugulare in presenza di ipertensione arteriosa polmonare e insorgenza di disfunzione diastolica del ventricolo destro.
L'impulso apicale nella stenosi mitralica è spesso normale o ridotto, il che riflette la normale funzione del ventricolo sinistro e una riduzione del suo volume. Un primo tono palpabile nella regione precordiale indica una mobilità conservata del lembo anteriore della valvola mitrale. Nella posizione a ventricolo sinistro, è possibile palpare un tremore diastolico. Con lo sviluppo di ipertensione polmonare, si nota un impulso cardiaco lungo il margine destro dello sterno.
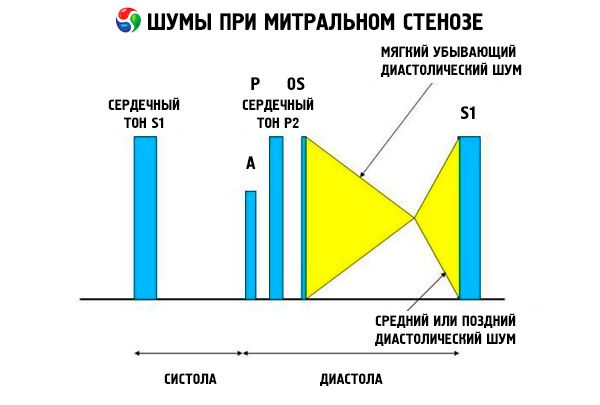
Il quadro ascoltato della stenosi mitralica è abbastanza caratteristico e comprende i seguenti segni:
- 1° tono amplificato (battito di mani), la cui intensità diminuisce con il progredire della stenosi;
- il tono di apertura della valvola mitrale successivo al secondo tono, che scompare con la calcificazione della valvola;
- soffio diastolico con massimo all'apice (mesodiastolico, presistolico, pandiastolico), che deve essere auscultato in posizione laterale sinistra.
L'auscultazione rivela un forte rumore di apertura (S1) causato dalle cuspidi della valvola mitrale stenotica che si chiudono bruscamente, come una vela che si "gonfia"; questo fenomeno è meglio udibile all'apice. Si ode comunemente anche una sdoppiatura della S con una P allargata dovuta all'ipertensione arteriosa polmonare. Il più evidente è lo schiocco diastolico precoce delle cuspidi che si aprono nel ventricolo sinistro (VS), che è più forte al margine sternale inferiore sinistro. È accompagnato da un soffio diastolico basso, in crescendo, che è meglio udibile con uno stetoscopio a imbuto all'apice del cuore (o sopra l'impulso apicale palpabile) a fine espirazione quando il paziente è sdraiato sul lato sinistro. Il suono di apertura può essere debole o assente se la valvola mitrale è sclerotica, fibrotica o ispessita. Il rumore di apertura si avvicina alla P (aumentando la durata del soffio) con l'aumentare della gravità della stenosi mitralica e della pressione atriale sinistra. Il soffio diastolico aumenta con la manovra di Valsalva (quando il sangue fluisce nell'atrio sinistro), dopo l'esercizio fisico, accovacciandosi e stringendo le mani. Può essere meno pronunciato se il ventricolo destro dilatato sposta posteriormente il ventricolo sinistro e quando altre patologie (ipertensione arteriosa polmonare, valvulopatia destra, fibrillazione atriale con elevata frequenza ventricolare) riducono il flusso sanguigno attraverso la valvola mitrale. L'aumento presistolico è dovuto al restringimento dell'orifizio della valvola mitrale durante la contrazione del ventricolo sinistro, che si verifica anche nella fibrillazione atriale, ma solo alla fine della diastole breve, quando la pressione atriale sinistra è ancora elevata.
I seguenti soffi diastolici possono essere associati al soffio della stenosi mitralica:
- Soffio di Graham Still (un soffio diastolico debole, decrescente, meglio udibile sul bordo sternale sinistro e causato da rigurgito della valvola polmonare dovuto a grave ipertensione polmonare);
- Soffio di Austin-Flint (soffio diastolico medio-tardivo udito all'apice del cuore e causato dall'effetto del flusso di rigurgito aortico sui lembi della valvola mitrale) quando la cardite reumatica colpisce le valvole mitrale e aortica.
I disturbi che causano soffi diastolici che imitano il soffio della stenosi mitralica includono il rigurgito mitralico (dovuto al flusso abbondante attraverso l'orifizio mitralico), il rigurgito aortico (che causa un soffio di Austin-Flint) e il mixoma atriale (che causa un soffio che in genere cambia intensità e posizione a ogni battito cardiaco).
La stenosi mitralica può causare sintomi di cardiopatia polmonare. Il segno classico della facies mitrale (arrossamento cutaneo color prugna nella zona dell'osso malare) si verifica solo quando la funzione cardiaca è ridotta e l'ipertensione polmonare è grave. Le cause della facies mitrale includono vasi cutanei dilatati e ipossiemia cronica.
Talvolta i primi sintomi della stenosi mitralica sono manifestazioni di ictus embolico o endocardite. Quest'ultima si verifica raramente nella stenosi mitralica non accompagnata da insufficienza mitralica.
 [ 22 ], [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ]
[ 22 ], [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ]
Manifestazioni cliniche dell'ipertensione polmonare nella stenosi mitralica
I primi sintomi dell'ipertensione polmonare sono aspecifici, il che rende molto più difficile una diagnosi precoce.
La dispnea è causata sia dalla presenza di ipertensione polmonare sia dall'incapacità del cuore di aumentare la gittata cardiaca durante l'esercizio fisico. La dispnea è solitamente di natura inspiratoria, è incostante all'esordio della malattia e si verifica solo durante uno sforzo fisico moderato; successivamente, con l'aumento della pressione nell'arteria polmonare, si manifesta anche durante uno sforzo fisico minimo e può essere presente anche a riposo. In caso di ipertensione polmonare elevata, può verificarsi una tosse secca. È importante ricordare che i pazienti possono inconsciamente limitare l'attività fisica, adattandosi a un certo stile di vita, quindi i sintomi di dispnea a volte sono assenti anche in caso di ipertensione polmonare indubbia.
Debolezza, aumento della stanchezza: le cause di questi disturbi possono essere una gittata cardiaca fissa (la quantità di sangue espulsa nell'aorta non aumenta in risposta allo sforzo fisico), un aumento della resistenza vascolare polmonare e una diminuzione della perfusione degli organi periferici e dei muscoli scheletrici dovuta a una circolazione periferica compromessa.
Vertigini e svenimenti sono causati dall'encefalopatia ipossica e sono solitamente provocati da sforzo fisico.
Un dolore persistente dietro e a sinistra dello sterno è causato dall'iperestensione dell'arteria polmonare e da un insufficiente apporto di sangue al miocardio ipertrofico (insufficienza coronarica relativa).
Palpitazioni cardiache e battito cardiaco irregolare. Questi sintomi sono associati alla frequente insorgenza di fibrillazione atriale.
L'emottisi si verifica a seguito della rottura delle anastomosi polmone-bronchiali sotto l'influenza di un'elevata ipertensione polmonare venosa e può anche essere conseguenza dell'aumento della pressione nei capillari polmonari e della fuoriuscita di plasma ed eritrociti nel lume degli alveoli. L'emottisi può anche essere un sintomo di embolia polmonare e infarto polmonare.
Per caratterizzare la gravità dell'ipertensione polmonare si utilizza la classificazione funzionale proposta dall'OMS per i pazienti con insufficienza circolatoria:
- Classe I - pazienti con ipertensione polmonare, ma senza limitazione dell'attività fisica. L'attività fisica normale non causa mancanza di respiro, debolezza, dolore toracico, vertigini;
- Classe II - pazienti con ipertensione polmonare, che comporta una certa riduzione dell'attività fisica. A riposo, si sentono a proprio agio, ma la normale attività fisica è accompagnata dalla comparsa di mancanza di respiro, debolezza, dolore toracico e vertigini;
- Classe III - pazienti con ipertensione polmonare, che comporta una marcata limitazione dell'attività fisica. A riposo, si sentono a proprio agio, ma una lieve attività fisica causa mancanza di respiro, debolezza, dolore toracico e vertigini;
- Classe IV - pazienti con ipertensione polmonare che non possono svolgere alcuna attività fisica senza i sintomi elencati. A volte si presentano mancanza di respiro o debolezza anche a riposo; il disagio aumenta con un'attività fisica minima.
Dove ti fa male?
Forme
La stenosi mitralica è classificata in base alla gravità (aggiornamento delle linee guida ACC/AHA/ASE 2003 per l'applicazione clinica dell'ecocardiografia).
Classificazione della stenosi mitralica per grado
Grado di stenosi |
Area dell'orifizio mitrale, cm2 |
Gradiente trasmitrale, mmHg |
Pressione sistolica nell'arteria polmonare, mm Hg |
Facile |
>1,5 |
<5 |
<30 |
Moderare |
1,0-1,5 |
5-10 |
30-50 |
Pesante |
<1 0 |
>10 |
>50 |
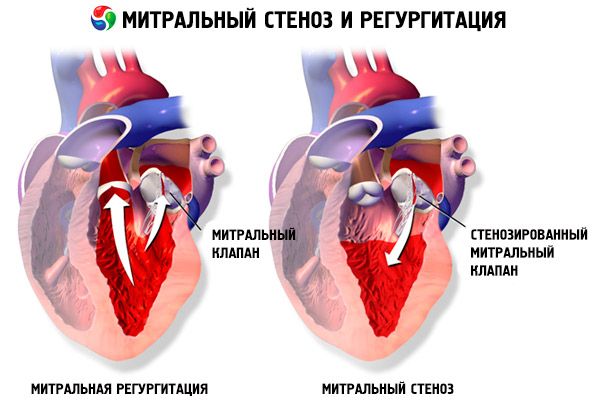
Nella stenosi mitralica, i lembi della valvola mitrale diventano ispessiti e immobili, e l'orifizio mitralico si restringe a causa della fusione delle commissure. La causa più comune è la febbre reumatica, sebbene la maggior parte dei pazienti non ricordi di averla avuta. Cause più rare includono la stenosi mitralica congenita, l'endocardite infettiva, il lupus eritematoso sistemico, il mixoma atriale, l'artrite reumatoide e la sindrome da carcinoide maligna con shunt atriale destro-sinistro. L'insufficienza mitralica (IM) può coesistere con la stenosi mitralica se la valvola non si chiude completamente. Molti pazienti con stenosi mitralica dovuta a febbre reumatica presentano anche insufficienza aortica.
L'area normale dell'orifizio della valvola mitrale è di 4-6 cm² . Un'area di 1-2 cm² indica una stenosi mitralica da moderata a grave e spesso causa sintomi clinici durante l'esercizio fisico. Un'area < 1 cm² rappresenta una stenosi critica e può causare sintomi a riposo. Le dimensioni e la pressione dell'atrio sinistro aumentano progressivamente per compensare la stenosi mitralica. Anche la pressione venosa e capillare polmonare aumenta e può causare ipertensione polmonare secondaria, con conseguente insufficienza ventricolare destra e rigurgito tricuspidale e polmonare. La velocità di progressione della patologia varia.
La patologia delle valvole con dilatazione dell'atrio sinistro predispone allo sviluppo di fibrillazione atriale (FA) e tromboembolia.
Diagnostica stenosi mitralica
La diagnosi preliminare viene formulata clinicamente e confermata dall'ecocardiografia. L'ecocardiografia bidimensionale fornisce informazioni sul grado di calcificazione valvolare, sulle dimensioni dell'atrio sinistro e sulla stenosi. L'ecocardiografia Doppler fornisce informazioni sul gradiente transvalvolare e sulla pressione arteriosa polmonare. L'ecocardiografia transesofagea può essere utilizzata per individuare o escludere piccoli trombi nell'atrio sinistro, in particolare nell'auricola sinistra, spesso non rilevabili con l'esame transtoracico.
La radiografia del torace mostra tipicamente la scomparsa del margine cardiaco sinistro a causa della dilatazione dell'auricola sinistra. Il tronco principale dell'arteria polmonare può essere visibile; il diametro dell'arteria polmonare destra discendente supera i 16 mm in caso di ipertensione polmonare grave. Le vene polmonari dei lobi superiori possono essere dilatate a causa della compressione delle vene dei lobi inferiori, che causa congestione a livello dei lobi superiori. Lungo il contorno cardiaco destro si può osservare una doppia ombra di un atrio sinistro dilatato. Linee orizzontali nei campi polmonari posteriori inferiori (linee di Kerley) indicano un edema interstiziale associato a un'elevata pressione atriale sinistra.
Il cateterismo cardiaco è prescritto solo per la diagnosi preoperatoria della malattia coronarica: è possibile valutare la dilatazione dell'atrio sinistro, la pressione nelle arterie polmonari e la superficie valvolare.
L'ECG del paziente è caratterizzato dalla comparsa di una P-mitrale (ampia, con incisura PQ), una deviazione dell'asse elettrico del cuore verso destra, soprattutto con lo sviluppo di ipertensione polmonare, nonché ipertrofia del ventricolo destro (con stenosi mitralica isolata) e sinistro (in combinazione con insufficienza mitralica).
La gravità della stenosi viene valutata mediante ecografia Doppler. Il gradiente pressorio transmitralico medio e l'area della valvola mitrale possono essere determinati con elevata accuratezza utilizzando la tecnologia a onda continua. Di grande importanza è la valutazione del grado di ipertensione polmonare, nonché della concomitante insufficienza mitralica e aortica.
Ulteriori informazioni possono essere ottenute mediante un test da sforzo (ecocardiografia da stress) con registrazione del flusso ematico transmitralico e tricuspidale. Se l'area della valvola mitrale è < 1,5 cm² e il gradiente pressorio è > 50 mmHg (dopo stress), si deve prendere in considerazione la valvuloplastica mitralica con palloncino.
Inoltre, l'ecocontrasto spontaneo durante l'ecocardiografia transesofagea è un predittore indipendente di complicanze emboliche nei pazienti con stenosi mitralica.
L'ecocardiografia transesofagea consente di chiarire la presenza o l'assenza di un trombo atriale sinistro e di valutare il grado di insufficienza mitralica in caso di valvuloplastica mitralica con palloncino programmata. Inoltre, l'esame transesofageo consente di valutare accuratamente lo stato dell'apparato valvolare e la gravità delle alterazioni delle strutture sottovalvolari, nonché di valutare la probabilità di restenosi.
Il cateterismo cardiaco e dei grandi vasi viene eseguito quando è previsto un intervento chirurgico e i dati dei test non invasivi non forniscono un risultato definitivo. La misurazione diretta della pressione atriale e ventricolare sinistra richiede il cateterismo transettale, che è associato a un rischio ingiustificato. Un metodo indiretto per misurare la pressione atriale sinistra è la pressione di incuneamento dell'arteria polmonare.
Cosa c'è da esaminare?
Diagnosi differenziale
Con un esame attento, la diagnosi di valvulopatia mitralica è solitamente fuor di dubbio.
La stenosi mitralica si differenzia anche dal mixoma atriale sinistro, da altri difetti valvolari (insufficienza mitralica, stenosi tricuspidale), dal difetto del setto interatriale, dalla stenosi della vena polmonare e dalla stenosi mitralica congenita.
 [ 51 ], [ 52 ], [ 53 ], [ 54 ], [ 55 ], [ 56 ], [ 57 ]
[ 51 ], [ 52 ], [ 53 ], [ 54 ], [ 55 ], [ 56 ], [ 57 ]
Esempi di formulazione della diagnosi
- Cardiopatia reumatica. Valvulopatia mitralica combinata con stenosi predominante dell'orifizio atrioventricolare sinistro di III grado. Fibrillazione atriale, forma permanente, tachisistolia. Ipertensione polmonare moderata. Stadio NK PB, III FC.
- Cardiopatia reumatica. Difetto combinato della valvola mitrale. Sostituzione della valvola mitrale (Medinzh - 23) da DD/MM/GG. Stadio NK IIA, FC II.
Chi contattare?
Trattamento stenosi mitralica
Gli obiettivi principali del trattamento dei pazienti con stenosi mitralica sono migliorare la prognosi, aumentare l'aspettativa di vita e alleviare i sintomi della malattia.
Ai pazienti asintomatici si consiglia di limitare l'attività fisica intensa. In caso di scompenso cardiaco e insufficienza cardiaca cronica, si raccomanda una restrizione alimentare del sodio.
Trattamento farmacologico della stenosi mitralica
La terapia farmacologica può essere utilizzata per controllare i sintomi della stenosi mitralica, ad esempio in preparazione a un intervento chirurgico. I diuretici riducono la pressione atriale sinistra e alleviano i sintomi associati alla stenosi mitralica. Tuttavia, i diuretici devono essere usati con cautela perché possono ridurre la gittata cardiaca. I beta-bloccanti e i calcio-antagonisti (verapamil e diltiazem) riducono la frequenza cardiaca a riposo e durante l'esercizio fisico, migliorando il riempimento ventricolare sinistro prolungando la diastole. Questi farmaci possono alleviare i sintomi associati all'attività fisica e sono particolarmente indicati nella tachicardia sinusale e nella fibrillazione atriale.
La fibrillazione atriale è una complicanza comune della stenosi mitralica, soprattutto negli anziani. Il rischio di tromboembolia in presenza di fibrillazione atriale aumenta significativamente (la sopravvivenza a 10 anni è del 25% nei pazienti rispetto al 46% nei pazienti in ritmo sinusale).
Sono indicati gli anticoagulanti indiretti (warfarin, dose iniziale 2,5-5,0 mg, sotto controllo INR);
- tutti i pazienti con stenosi mitralica complicata da fibrillazione atriale (forma parossistica, persistente o permanente);
- pazienti con anamnesi di eventi embolici, anche con ritmo sinusale conservato;
- pazienti con un trombo nell'atrio sinistro;
- pazienti con stenosi mitralica grave e pazienti la cui dimensione dell'atrio sinistro è >55 mm.
Il trattamento viene effettuato sotto il controllo dell'INR, i cui livelli target sono compresi tra 2 e 3. Se il paziente sviluppa complicanze emboliche nonostante il trattamento anticoagulante, si raccomanda di aggiungere acido acetilsalicilico alla dose di 75-100 mg/die (alternative sono dipiridamolo o clopidogrel). È opportuno sottolineare che non sono stati condotti studi clinici randomizzati e controllati sull'uso di anticoagulanti in pazienti con stenosi mitralica; le raccomandazioni si basano sull'estrapolazione di dati ottenuti in coorti di pazienti con fibrillazione atriale.
Poiché lo sviluppo di fibrillazione atriale in un paziente con stenosi mitralica è accompagnato da scompenso, il trattamento mirato a rallentare il ritmo ventricolare è di primaria importanza. Come già accennato, i beta-bloccanti, il verapamil o il diltiazem possono essere i farmaci di scelta. Anche la digossina può essere utilizzata, ma il suo intervallo terapeutico ristretto e la sua minore capacità di prevenire l'accelerazione della frequenza cardiaca durante l'esercizio fisico ne limitano l'uso rispetto ai beta-bloccanti. Anche la cardioversione elettrica è di utilità limitata nella fibrillazione atriale persistente, poiché senza trattamento chirurgico la probabilità di recidiva è molto elevata.
Trattamento chirurgico della stenosi mitralica
Il metodo principale per curare la stenosi mitralica è chirurgico, poiché ad oggi non esiste alcun trattamento farmacologico in grado di rallentare la progressione della stenosi.
Nei pazienti con sintomi più gravi o evidenza di ipertensione arteriosa polmonare è necessaria la valvulotomia, la commissurotomia o la sostituzione della valvola.
La procedura di scelta è la valvuloplastica mitralica percutanea con palloncino. Questa è la principale tecnica di trattamento chirurgico della stenosi mitralica. Vengono inoltre utilizzate la commissurotomia a cielo aperto e la sostituzione della valvola mitrale.
La valvulotomia percutanea con palloncino è la tecnica preferita per i pazienti più giovani, i pazienti più anziani che non tollerano procedure più invasive e i pazienti senza calcificazioni valvolari significative, deformità sottovalvolari, trombi atriali sinistri o insufficienza mitralica significativa. In questa procedura, sotto guida ecocardiografica, un palloncino viene inserito attraverso il setto atriale dall'atrio destro a quello sinistro e gonfiato per separare i lembi valvolari mitralici fusi. I risultati sono paragonabili a quelli delle procedure più invasive. Le complicanze sono rare e includono insufficienza mitralica, embolia, perforazione ventricolare sinistra e difetto del setto interatriale, che probabilmente persiste se la differenza di pressione interatriale è elevata.
La valvuloplastica mitralica percutanea con palloncino è indicata per i seguenti gruppi di pazienti con un'area dell'orifizio mitralico inferiore a 1,5 cm 2:
- pazienti scompensati con caratteristiche favorevoli per la valvuloplastica mitralica percutanea (classe I, livello di evidenza B);
- pazienti scompensati con controindicazioni al trattamento chirurgico o ad alto rischio chirurgico (classe I, livello di evidenza! IC);
- in caso di correzione chirurgica primaria programmata del difetto in pazienti con morfologia valvolare inadatta, ma con caratteristiche cliniche soddisfacenti (classe IIa, livello di evidenza C);
- pazienti "asintomatici" con caratteristiche morfologiche e cliniche idonee, ad alto rischio di complicanze tromboemboliche o ad alto rischio di scompenso dei parametri emodinamici;
- con una storia di complicanze emboliche (classe IIa, livello di evidenza C);
- con il fenomeno dell’ecocontrasto spontaneo nell’atrio sinistro (classe IIa, livello di evidenza C);
- con fibrillazione atriale permanente o parossistica (classe IIa, livello di evidenza C);
- con pressione sistolica dell'arteria polmonare superiore a 50 mmHg (classe IIa, livello di evidenza C);
- quando sono necessari importanti interventi chirurgici non cardiaci (classe IIa, livello di evidenza C);
- in caso di pianificazione di una gravidanza (classe IIa, livello di evidenza C).
Le caratteristiche idonee per la valvuloplastica mitralica percutanea sono l'assenza delle seguenti caratteristiche:
- clinici: età avanzata, anamnesi di commissurotomia, insufficienza cardiaca funzionale di classe IV, fibrillazione atriale, ipertensione polmonare grave;
- Morfologico: calcificazione della valvola mitrale di qualsiasi grado, valutata mediante fluorografia, area della valvola mitrale molto piccola, grave insufficienza tricuspidale.
I pazienti con grave patologia sottovalvolare, calcificazione valvolare o trombi nell'atrio sinistro possono essere candidati alla commissurotomia, in cui i lembi valvolari mitralici fusi vengono separati utilizzando un dilatatore inserito attraverso l'atrio e il ventricolo sinistro (commissurotomia chiusa) o manualmente (commissurotomia aperta). Entrambe le procedure richiedono una toracotomia. La scelta dipende dalla situazione chirurgica e dal grado di fibrosi e calcificazione.
L'intervento di chirurgia plastica (commissurotomia aperta) o di sostituzione della valvola mitrale viene eseguito per le seguenti indicazioni di classe I.
In presenza di scompenso cardiaco III-IV FC e stenosi mitralica moderata o grave nei casi in cui:
- non è possibile eseguire la valvuloplastica mitralica con palloncino;
- La valvuloplastica mitralica con palloncino è controindicata a causa di un trombo nell'atrio sinistro nonostante l'uso di anticoagulanti, o a causa di una concomitante insufficienza mitralica moderata o grave;
- la morfologia della valvola non è adatta alla valvuloplastica mitralica con palloncino.
Nella stenosi mitralica da moderata a grave e concomitante insufficienza mitralica da moderata a grave (la sostituzione della valvola è indicata se la riparazione della valvola non è possibile).
La sostituzione valvolare è l'ultima risorsa. Viene prescritta ai pazienti con area della valvola mitrale < 1,5 cm² , sintomi da moderati a gravi e patologie valvolari (ad esempio, fibrosi) che impediscono l'uso di altri metodi.
La sostituzione della valvola mitrale è consigliabile (indicazioni di classe IIa) in caso di stenosi mitralica grave e ipertensione polmonare grave (pressione sistolica dell'arteria polmonare superiore a 60 mmHg), sintomi di scompenso cardiaco di classe I-II, a meno che non venga suggerita una valvuloplastica mitralica con palloncino o la sostituzione della valvola mitrale. I pazienti con stenosi mitralica che non presentano sintomi di scompenso devono essere sottoposti a visita medica annuale. La visita include la raccolta dei sintomi, l'anamnesi, l'esame obiettivo, la radiografia del torace e l'ECG. Se le condizioni del paziente sono cambiate nel periodo precedente o i risultati della visita precedente indicano una stenosi mitralica grave, è indicata un'ecocardiografia. In tutti gli altri casi, l'ecocardiografia annuale non è necessaria. Se il paziente lamenta palpitazioni, si raccomanda un monitoraggio ECG delle 24 ore (Holter) per rilevare parossismi di fibrillazione atriale.
Durante la gravidanza, le pazienti con stenosi lieve o moderata possono ricevere solo un trattamento farmacologico. L'uso di diuretici e beta-bloccanti è sicuro. Se è necessario un trattamento anticoagulante, alle pazienti vengono prescritte iniezioni di eparina, poiché il warfarin è controindicato.
Prevenzione
La questione più importante nella strategia di ulteriore gestione dei pazienti con stenosi mitralica è la prevenzione delle recidive di febbre reumatica con penicilline a rilascio prolungato prescritte a vita, così come a tutti i pazienti dopo correzione chirurgica del difetto (anche per la prevenzione dell'endocardite infettiva). La benzatina benzilpenicillina viene prescritta alla dose di 2,4 milioni di U per gli adulti e 1,2 milioni di U per i bambini, per via intramuscolare una volta al mese.
Tutti i pazienti con stenosi mitralica sono indicati per la prevenzione secondaria delle recidive di febbre reumatica. Inoltre, tutti i pazienti sono indicati per la prevenzione dell'endocardite infettiva.
I pazienti asintomatici necessitano solo di profilassi contro la febbre reumatica ricorrente [ad esempio, iniezioni intramuscolari di benzilpenicillina (penicillina G sale sodico sterile) 1,2 milioni di unità ogni 3 o 4 settimane] fino all'età di 25-30 anni e profilassi contro l'endocardite prima di procedure rischiose.
Previsione
La storia naturale della stenosi mitralica varia, ma il tempo che intercorre tra l'insorgenza dei sintomi e la grave disabilità è di circa 7-9 anni. L'esito del trattamento dipende dall'età del paziente, dallo stato funzionale, dall'ipertensione arteriosa polmonare e dal grado di fibrillazione atriale. I risultati della valvulotomia e della commissurotomia sono equivalenti, con entrambi i metodi che ripristinano la funzionalità valvolare nel 95% dei pazienti. Tuttavia, la funzionalità si deteriora nel tempo nella maggior parte dei pazienti e molti richiedono una ripetizione della procedura. I fattori di rischio per il decesso includono la fibrillazione atriale e l'ipertensione polmonare. La causa del decesso è solitamente lo scompenso cardiaco o l'embolia polmonare o cerebrovascolare.
La stenosi mitralica di solito progredisce lentamente e ha un lungo periodo di compenso. Oltre l'80% dei pazienti sopravvive per 10 anni senza sintomi o segni moderati di scompenso cardiaco congestizio (FCC I-II secondo NUHA). Il tasso di sopravvivenza a 10 anni dei pazienti scompensati e non operati è significativamente peggiore e non supera il 15%. In caso di sviluppo di ipertensione polmonare grave, il periodo di sopravvivenza medio non supera i 3 anni.
 [ 74 ]
[ 74 ]

