Esperto medico dell'articolo
Nuove pubblicazioni
Sindrome di Goodpasture: cause, sintomi, diagnosi, trattamento
Ultima recensione: 12.07.2025

Tutti i contenuti di iLive sono revisionati o verificati da un punto di vista medico per garantire la massima precisione possibile.
Abbiamo linee guida rigorose in materia di sourcing e colleghiamo solo a siti di media affidabili, istituti di ricerca accademici e, ove possibile, studi rivisti dal punto di vista medico. Nota che i numeri tra parentesi ([1], [2], ecc.) Sono link cliccabili per questi studi.
Se ritieni che uno qualsiasi dei nostri contenuti sia impreciso, scaduto o comunque discutibile, selezionalo e premi Ctrl + Invio.
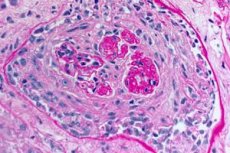
La sindrome di Goodpasture è una sindrome autoimmune che comporta emorragia polmonare alveolare e glomerulonefrite causate da anticorpi anti-GBM circolanti. La sindrome di Goodpasture si sviluppa più spesso in individui con predisposizione genetica che fumano sigarette, ma l'inalazione di idrocarburi e le infezioni virali delle vie respiratorie sono possibili fattori aggiuntivi. I sintomi della sindrome di Goodpasture includono dispnea, tosse, affaticamento, emottisi e/o ematuria. La sindrome di Goodpasture viene sospettata nei pazienti con emottisi o ematuria ed è confermata dalla presenza di anticorpi anti-GBM nel sangue. Il trattamento della sindrome di Goodpasture include plasmaferesi, glucocorticoidi e immunosoppressori come la ciclofosfamide. La prognosi è buona se il trattamento viene iniziato prima che si sviluppi insufficienza respiratoria o renale.
La sindrome di Goodpasture fu descritta per la prima volta da Goodpasture nel 1919. La sindrome di Goodpasture è una combinazione di glomerulonefrite ed emorragia alveolare in presenza di anticorpi anti-GBM. La sindrome di Goodpasture si presenta più spesso come una combinazione di emorragia alveolare diffusa e glomerulonefrite, ma a volte causa glomerulonefrite isolata (10-20%) o interessamento polmonare (10%). Gli uomini sono colpiti più frequentemente delle donne.
Quali sono le cause della sindrome di Goodpasture?
La causa della malattia non è stata determinata con precisione. Si ipotizza una predisposizione genetica alla sindrome di Goodpasture; il suo marcatore è considerato la presenza dell'HLA-DRW2. Esiste un punto di vista sul possibile ruolo di una precedente infezione virale (virus dell'epatite A e altre malattie virali), rischi industriali e farmaci (principalmente D-penicillamina).
La base della patogenesi della sindrome di Goodpasture è la formazione di autoanticorpi contro le membrane basali dei capillari glomerulari dei reni e degli alveoli. Questi anticorpi appartengono alla classe delle IgG e si legano agli anticorpi delle membrane basali in presenza della componente C3 del complemento, con il conseguente sviluppo di infiammazione immunitaria a livello dei reni e degli alveoli polmonari.
Gli anticorpi anti-GBM sono diretti contro il dominio non collagenoso (NC-1) della catena 3 del collagene di tipo IV, che si trova in massima concentrazione nelle membrane basali dei capillari renali e polmonari. L'esposizione a fattori ambientali - fumo, infezioni virali respiratorie acute (ARI) e inalazione di sospensioni di idrocarbonati (più spesso) - e, meno frequentemente, polmonite, attiva la presentazione degli antigeni dei capillari alveolari agli anticorpi circolanti nelle persone con predisposizione ereditaria (il più delle volte portatori degli alleli HLA-DRwl5, -DR4 e -DRB1). Gli anticorpi anti-GBM circolanti si legano alle membrane basali, fissano il complemento e inducono una risposta infiammatoria cellulare, portando allo sviluppo di glomerulonefrite e/o capillarite polmonare.
Esiste probabilmente una certa comunanza di autoantigeni della membrana basale dei capillari glomerulari dei reni e degli alveoli. L'autoantigene si forma sotto l'influenza dell'effetto lesivo del fattore eziologico. Un fattore eziologico sconosciuto danneggia e modifica la struttura delle membrane basali di reni e polmoni. L'escrezione dei prodotti di degradazione risultanti dalle membrane basali glomerulari dei reni rallenta e diminuisce quando queste vengono danneggiate, il che crea naturalmente i prerequisiti per lo sviluppo di danni autoimmuni a reni e polmoni. Non è ancora completamente noto quale componente della membrana basale diventi l'autoantigene. Attualmente, si presume che si tratti del componente strutturale interno della membrana basale glomerulare del rene, la catena α3 del collagene di tipo 4.
I complessi immunitari formati si depositano lungo le membrane basali dei capillari glomerulari, il che porta allo sviluppo di un processo infiammatorio immunitario nel glomerulo renale (glomerulonefrite) e negli alveoli (alveolite). Le principali cellule coinvolte nello sviluppo di questa infiammazione immunitaria sono linfociti T, monociti, endoteliociti, leucociti polimorfonucleati e macrofagi alveolari. L'interazione tra loro è assicurata da mediatori molecolari, citochine (fattori di crescita - piastrinici, insulino-simili, β-trasformanti; interleuchina-1, fattore di necrosi tumorale, ecc.). I metaboliti dell'acido arachidonico, i radicali liberi dell'ossigeno, gli enzimi proteolitici e le molecole adesive svolgono un ruolo importante nello sviluppo dell'infiammazione immunitaria.
L'attivazione dei macrofagi alveolari è di grande importanza nello sviluppo dell'alveolite nella sindrome di Goodpasture. Nello stato attivato, secernono circa 40 citochine. Le citochine del gruppo I (chemiotassine, leucotrieni, interleuchina-8) aumentano il flusso di leucociti polimorfonucleati nei polmoni. Le citochine del gruppo II (fattori di crescita - piastrine, macrofagi) promuovono il movimento dei fibroblasti nei polmoni. I macrofagi alveolari producono anche forme attive di ossigeno, le proteasi, che danneggiano il tessuto polmonare.
Patomorfologia della sindrome di Goodpasture
Le principali manifestazioni patomorfologiche della sindrome di Goodpasture sono:
- Danni predominanti al letto microcircolatorio di reni e polmoni. Nei polmoni si osserva un quadro di venulite, arteriolite, capillarite con marcati fenomeni di distruzione e proliferazione; danni ai capillari si osservano principalmente nei setti interalveolari, con sviluppo di alveolite con essudato emorragico negli alveoli. Il danno renale è caratterizzato dallo sviluppo di glomerulonefrite proliferativa extracapillare con successiva formazione di ialinosi e fibrosi, che porta allo sviluppo di insufficienza renale;
- emorragie intra-alveolari pronunciate;
- sviluppo di emosiderosi polmonare e pneumosclerosi di gravità variabile, a seguito dell'evoluzione dell'alveolite.
Sintomi della sindrome di Goodpasture
La malattia si presenta più spesso con manifestazioni cliniche di patologia polmonare. L'emottisi è il sintomo più evidente; tuttavia, l'emottisi può essere assente in presenza di manifestazioni emorragiche e il paziente può presentare solo alterazioni infiltrative alla radiografia del torace o un infiltrato e difficoltà e/o insufficienza respiratoria. Sono comuni dispnea (principalmente da sforzo), tosse, malessere, ridotta capacità lavorativa, dolore toracico, febbre e perdita di peso. Fino al 40% dei pazienti presenta macroematuria, sebbene l'emorragia polmonare possa precedere le manifestazioni renali di settimane o anni.
Durante l'emottisi, la mancanza di respiro può aumentare. Anche la debolezza e la ridotta capacità lavorativa sono motivo di preoccupazione.
I sintomi della sindrome di Goodpasture variano nel tempo, spaziando da polmoni chiari all'auscultazione a rantoli secchi e crepitanti. Alcuni pazienti presentano edema periferico e pallore dovuti all'anemia.
Durante l'esame obiettivo, l'attenzione viene attirata da pallore cutaneo, cianosi delle mucose, pastosità o gonfiore pronunciato del viso, riduzione della forza muscolare e perdita di peso. La temperatura corporea è solitamente elevata fino a livelli febbrili.
Percuotendo i polmoni, si può riscontrare un accorciamento del suono di percussione in corrispondenza di estesi focolai di emorragia polmonare, ma ciò si osserva raramente; più spesso, non si notano alterazioni nel suono di percussione.
Un segno auscultatorio caratteristico della sindrome di Goodpasture è il respiro sibilante secco e umido, la cui intensità aumenta significativamente durante o dopo l'emottisi.
Esaminando il sistema cardiovascolare, si evidenzia ipertensione arteriosa, possibile aumento del limite di ottusità cardiaca relativa a sinistra, toni cardiaci ovattati, un lieve soffio sistolico e un soffio da sfregamento pericardico con sviluppo di grave insufficienza renale. In caso di progressivo danno renale, in concomitanza con significativa ipertensione arteriosa, può svilupparsi un'insufficienza ventricolare sinistra acuta con quadro di asma cardiaco ed edema polmonare. Di solito, questa situazione si sviluppa nella fase terminale della malattia.
Di norma, il danno renale si manifesta più tardi, dopo un certo periodo di tempo dalla comparsa dei sintomi polmonari. I segni clinici caratteristici della patologia renale sono ematuria (talvolta macroematuria), insufficienza renale a rapida progressione, oliguria e ipertensione arteriosa.
Nel 10-15% dei casi, la sindrome di Goodpasture esordisce con segni clinici di patologia renale: compare il quadro clinico della glomerulonefrite (oliguria, edema, ipertensione arteriosa, pallore pronunciato), a cui si aggiungono poi sintomi di danno polmonare. Molti pazienti possono presentare mialgia e artralgia.
Indipendentemente dalle varianti di esordio, la sindrome di Goodpasture nella maggior parte dei casi è grave, la malattia progredisce progressivamente e si sviluppa grave insufficienza polmonare e renale. L'aspettativa di vita dei pazienti dall'esordio della malattia varia da diversi mesi a 1-3 anni. Il più delle volte, i pazienti muoiono per uremia o emorragia polmonare.
Cosa ti infastidisce?
Diagnosi della sindrome di Goodpasture
La diagnosi di sindrome di Goodpasture richiede la rilevazione di anticorpi sierici anti-GBM mediante immunofluorescenza indiretta o, quando disponibile, mediante saggio immunoenzimatico (ELISA) diretto con NC-1α3 umano ricombinante. Altri test sierologici, come il test degli anticorpi antinucleo (ANA), vengono utilizzati per rilevare il LES e il titolo antistreptolisina-O per rilevare la glomerulonefrite poststreptococcica, che può essere la causa di molti casi di sindrome pneumo-renale. Gli ANCA sono positivi (in campioni periferici) nel 25% dei casi di sindrome di Goodpasture. La biopsia renale può essere indicata in presenza di glomerulonefrite (ematuria, proteinuria, fango eritrocitario nelle urine e/o insufficienza renale). Nella sindrome di Goodpasture e in tutte le altre cause di sindrome pneumo-renale, la biopsia evidenzia una glomerulonefrite necrotizzante focale segmentale rapidamente progressiva con decorso progressivo. La colorazione immunofluorescente del tessuto renale o polmonare rivela classicamente la deposizione lineare di IgG lungo i capillari glomerulari o alveolari. È presente anche nella glomerulonefrite diabetica e nella glomerulonefrite fibrillare, una rara malattia che causa la sindrome pneumo-renale, ma la rilevazione degli anticorpi contro il GBM in queste patologie è aspecifica.
I test di funzionalità polmonare e il lavaggio broncoalveolare non sono diagnostici per la sindrome di Goodpasture, ma possono essere utilizzati per confermare la presenza di emorragia alveolare diffusa in pazienti con glomerulonefrite e infiltrati polmonari ma senza emottisi. Il liquido di lavaggio che rimane emorragico dopo ripetuti lavaggi può confermare la sindrome emorragica diffusa, soprattutto in presenza di una concomitante diminuzione dell'ematocrito.
 [ 3 ]
[ 3 ]
Diagnostica di laboratorio della sindrome di Goodpasture
- Analisi del sangue generale. I segni caratteristici sono anemia ipocromica sideropenica, ipocromia, anisocitosi, poichilocitosi degli eritrociti. Si osservano anche leucocitosi, spostamento a sinistra della formula leucocitaria e un aumento significativo della VES.
- Analisi generale delle urine. Nelle urine si riscontrano proteine (il grado di proteinuria può essere significativo), cilindri (granulari, ialini, eritrocitari), eritrociti (può verificarsi macroematuria). Con il progredire dell'insufficienza renale cronica, la densità relativa delle urine diminuisce e si sviluppa isoipostenuria nel test di Zimnitsky.
- Esame biochimico del sangue. Aumento dei livelli ematici di urea, creatinina, aptoglobina, sieromucoide, α2 e gammaglobuline, diminuzione del contenuto di ferro.
- Studi immunologici. È possibile rilevare una diminuzione del numero di linfociti T soppressori e la presenza di immunocomplessi circolanti. Gli anticorpi contro la membrana basale dei capillari glomerulari e alveolari vengono rilevati mediante immunofluorescenza indiretta o metodi radioimmunologici.
- Analisi dell'espettorato. L'espettorato contiene molti eritrociti, emosiderina e siderofagi.
Diagnostica strumentale della sindrome di Goodpasture
- Esame radiografico dei polmoni. I segni radiografici caratteristici sono infiltrati polmonari nella regione radicolare che si diffondono ai polmoni inferiori e medi, nonché infiltrati nebulosi progressivi, simmetrici e bilaterali.
- Studio della funzione della respirazione esterna. La spirometria rivela un'insufficienza respiratoria di tipo restrittivo (riduzione della capacità vitale); con il progredire della malattia, si aggiunge un'insufficienza respiratoria di tipo ostruttivo (riduzione del FEV1, indice di Tiffeneau).
- ECG. Si evidenziano segni di grave distrofia miocardica a genesi anemica e ipossica (riduzione dell'ampiezza delle onde T e del tratto ST in molte derivazioni, più frequentemente nelle derivazioni toraciche sinistre). In caso di grave ipertensione arteriosa, compaiono segni di ipertrofia miocardica ventricolare sinistra.
- L'analisi dei gas nel sangue rivela ipossiemia arteriosa.
- Esame di biopsie polmonari e renali. Una biopsia del tessuto polmonare (biopsia aperta) e dei reni viene eseguita per la verifica definitiva della diagnosi qualora sia impossibile diagnosticare accuratamente la malattia con metodi non invasivi. Viene eseguito l'esame istologico e immunologico delle biopsie. I seguenti segni sono caratteristici della sindrome di Goodpasture:
- la presenza di segni morfologici di glomerulonefrite (il più delle volte extracapillare), alveolite emorragica, emosiderosi e fibrosi interstiziale;
- rilevazione di depositi lineari di IgG e del componente C3 del complemento sulle membrane basali degli alveoli polmonari e dei glomeruli renali mediante il metodo dell'immunofluorescenza.
Criteri diagnostici per la sindrome di Goodpasture
Per formulare una diagnosi della sindrome di Goodpasture è consigliabile utilizzare i seguenti criteri.
- Una combinazione di patologia polmonare e renale, vale a dire emottisi (spesso emorragia polmonare), mancanza di respiro e sintomi di glomerulonefrite.
- Decorso della malattia in costante progressione con sviluppo di insufficienza respiratoria e renale.
- Sviluppo di anemia sideropenica.
- Rilevamento durante l'esame radiografico dei polmoni di molteplici infiltrati bilaterali nebulosi sullo sfondo di una deformazione reticolare del quadro polmonare.
- Rilevazione nel sangue di titoli elevati di anticorpi circolanti contro la membrana basale dei glomeruli e degli alveoli renali.
- Rilevamento di depositi lineari di IgG e del componente C3 del complemento sulle membrane basali dei capillari glomerulari e alveolari.
- Assenza di altre manifestazioni sistemiche (eccetto polmonari e renali).
Diagnosi differenziale della sindrome di Goodpasture
La sindrome di Goodpasture deve essere differenziata da una serie di patologie che si manifestano con emottisi o emorragia polmonare. È necessario escludere patologie oncologiche dei bronchi e dei polmoni, tubercolosi, ascessi polmonari, bronchiectasie, malattie cardiache e vascolari (che portano a congestione e ipertensione polmonare), vasculite sistemica e diatesi emorragica.
Programma di screening della sindrome di Goodpasture
- Esami generali del sangue e delle urine.
- Esame biochimico del sangue: determinazione delle proteine totali e delle frazioni proteiche, creatinina e urea, transaminasi, sieromucoide, aptoglobina, fibrina, ferro.
- Analisi dell'espettorato: esame citologico, determinazione dei siderofagi.
- Studi immunologici: determinazione del contenuto di linfociti B e T, sottopopolazioni di linfociti T, immunoglobuline, immunocomplessi circolanti, anticorpi contro le membrane basali dei glomeruli renali e degli alveoli.
- Esame radiografico dei polmoni.
- Elettrocardiogramma.
- Spirometria.
- Esame delle biopsie polmonari e renali.
Quali test sono necessari?
Trattamento della sindrome di Goodpasture
Il trattamento della sindrome di Goodpasture prevede plasmaferesi giornaliera o a giorni alterni per 2-3 settimane (plasmaferesi da 4 L) per rimuovere gli anticorpi anti-GBM, in associazione a glucocorticoidi per via endovenosa (solitamente metilprednisolone 1 g in almeno 20 minuti a giorni alterni per 3 volte con prednisolone 1 mg/kg di peso corporeo al giorno) e ciclofosfamide (2 mg/kg una volta al giorno) per 6-12 mesi per prevenire la formazione di nuovi anticorpi. La terapia può essere ridotta gradualmente quando la funzionalità polmonare e renale non migliora più. La mortalità a lungo termine è correlata al grado di compromissione renale all'esordio della malattia; i pazienti che necessitano di dialisi precoce e quelli con più del 50% di nefroni a semiluna alla biopsia hanno tempi di sopravvivenza inferiori a 2 anni e spesso necessitano di dialisi a meno che non venga preso in considerazione il trapianto renale. L'emottisi può essere un buon segno prognostico perché porta a una diagnosi precoce della malattia; la minoranza di pazienti ANCA-positivi risponde meglio al trattamento per la sindrome di Goodpasture. La recidiva si verifica in una piccola percentuale di casi ed è associata al fumo persistente e alle infezioni delle vie respiratorie. Nei pazienti con insufficienza renale in fase terminale sottoposti a trapianto di rene, la malattia può recidivare nell'organo trapiantato.
Qual è la prognosi per la sindrome di Goodpasture?
La sindrome di Goodpasture spesso progredisce rapidamente e può essere fatale se non viene diagnosticata e trattata tempestivamente; la prognosi è buona se il trattamento viene iniziato prima che si sviluppi insufficienza respiratoria o renale.
La sopravvivenza immediata al momento dell'emorragia polmonare e dell'insufficienza respiratoria è associata alla garanzia della pervietà delle vie aeree; l'intubazione endotracheale e la ventilazione meccanica sono raccomandate per i pazienti con livelli di gas nel sangue arterioso borderline e imminente insufficienza respiratoria.

